题目内容
【题目】含氟牙膏可以保护我们的牙齿。我校化学项目学习小组对此真实性进行了如下探究。
(查阅资料)
①牙齿表面有一种含钙化合物保护层。
②鸡蛋壳主要成分是CaCO3,其他成分对实验影响忽略不计。
③鸡蛋壳、牙齿都能与含氟牙膏形成更耐酸的氟化钙。
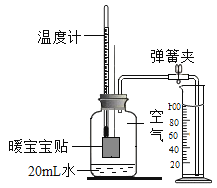
(实验一)先检查图2装置气密性,方法是______。取0.5g鸡蛋壳放入锥形瓶中,用注射器抽取20mL 3.5%的盐酸(模拟形成龋齿的酸境),可观察到鸡蛋壳表面有大量气泡生成。检验上述反应产生的气泡成分的方法为(用化学方程式表示)____。

(实验二)另取0.50g蛋壳,用牙膏液浸泡、洗涤、晾干后加入锥形瓶中,用注射器抽取______的盐酸进行实验,测得压强随时间的变化如图12所示。
(1)图1中x﹣y段压强增大的主要原因是_______。
(2)根据实验二所得数据分析,含氟牙膏______(填“能”或“不能”)预防龋齿,理由_______。
【答案】打开开关,拉动注射器活塞,松开后,活塞回到原位,说明气密性良好 ![]() 20mL 3.5% 碳酸盐和盐酸反应生成了二氧化碳,瓶内压强变大 能 相同条件下,使用含氟牙膏处理后的鸡蛋壳与酸反应生成的气体更少,压强更小,消耗的鸡蛋壳更少
20mL 3.5% 碳酸盐和盐酸反应生成了二氧化碳,瓶内压强变大 能 相同条件下,使用含氟牙膏处理后的鸡蛋壳与酸反应生成的气体更少,压强更小,消耗的鸡蛋壳更少
【解析】
碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳。
[实验一]检查图2装置气密性,方法是打开开关,拉动注射器活塞,松开后,活塞回到原位,说明气密性良好。鸡蛋壳的主要成分是碳酸钙,碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,反应的化学方程式为![]() 。
。
[实验二]探究过程中用控制变量法,需要控制盐酸的量和浓度相同,故另取0.50g蛋壳,用牙膏液浸泡、洗涤、晾干后加入锥形瓶中,用注射器抽取20mL 3.5%的盐酸进行实验。
(1)图1中x﹣y段压强增大的主要原因是碳酸盐和盐酸反应生成了二氧化碳,瓶内压强变大。
(2)根据图1图像可知,含氟牙膏处理的鸡蛋生成的气体较少,故含氟牙膏能预防龋齿,理由是相同条件下,使用含氟牙膏处理后的鸡蛋壳与酸反应生成的气体更少,压强更小,消耗的鸡蛋壳更少。

 名校课堂系列答案
名校课堂系列答案【题目】如图是木炭还原氧化铜的实验装置

(1)a中发生反应的化学方程式:_______。
(2)某实验探究性小组同学,发现a试管中还有少量黑色粉末剩余,于是设计方案验证黑色粉末的成分。
(查阅资料)氧化铜受热不与空气中成分反应
(作出猜想)黑色固体可能是:①只有碳,②_____③氧化铜和碳的混合物,
实验操作 | 现象 | 分析和结论 |
取少量剩余黑色粉末,在空气中加热 | _______ | 猜想(3)正确 |