题目内容
(12分)钢铁是使用最多的金属材料。在今年的化学活动周中,某校兴趣小组的同学在老师指导下做了二个有关铁的实验。
实验一:用干燥纯净的一氧化碳还原氧化铁
实验装置如下图:

其中A是实验室用草酸(H2C2O4)和浓硫酸加热制取一氧化碳的气体发生装置,反应的

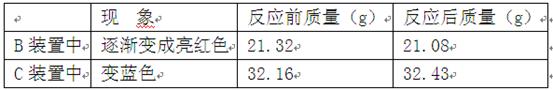
(1)B装置中发生反应的化学方程式是 .
(2)C装置无明显现象,C装置的作用是 。
D装置中浓硫酸的作用是 。
(3)E装置中的实验现象是 。
(4)F装置的作用是 、 。
实验二:铝粉和氧化铁粉末反应(铝热反应)
实验装置如下图:

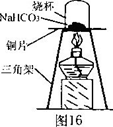
图中纸漏斗由两张滤纸折叠成漏斗状套在一起,使四周都有四层,点燃镁条后观察到的现象:镁条剧烈燃烧,发出耀眼的白光,放出大量的热,纸漏斗的下部被烧穿,有熔融物落入细沙中。
实验后老师作了如下提示:实验中镁条和氯酸钾的作用是提供反应所需的高温条件,铝粉和氧化铁粉末在高温条件下的反应叫铝热反应,属于置换反应,该反应常用于焊接钢轨。请写出该反应的化学方程式 。该反应中单质铝与一氧化碳有相似的 (填“氧化”或“还原”)性。
实验后同学们对金属与金属氧化物间的反应产生兴趣,激发了探究热情。
【提出问题】任何金属与金属氧化物在高温条件下都能反应吗?
同学们在请教老师后设计了如下实验方案并进行了探究。
【实验方案】
【实验总结】金属与金属氧化物在高温条件下有些能反应,有些不能反应。
【反思拓展】金属与金属氧化物在高温条件下反应的规律和金属与 的反应相似。
实验一:用干燥纯净的一氧化碳还原氧化铁
实验装置如下图:

其中A是实验室用草酸(H2C2O4)和浓硫酸加热制取一氧化碳的气体发生装置,反应的

(1)B装置中发生反应的化学方程式是 .
(2)C装置无明显现象,C装置的作用是 。
D装置中浓硫酸的作用是 。
(3)E装置中的实验现象是 。
(4)F装置的作用是 、 。
实验二:铝粉和氧化铁粉末反应(铝热反应)
实验装置如下图:

图中纸漏斗由两张滤纸折叠成漏斗状套在一起,使四周都有四层,点燃镁条后观察到的现象:镁条剧烈燃烧,发出耀眼的白光,放出大量的热,纸漏斗的下部被烧穿,有熔融物落入细沙中。
实验后老师作了如下提示:实验中镁条和氯酸钾的作用是提供反应所需的高温条件,铝粉和氧化铁粉末在高温条件下的反应叫铝热反应,属于置换反应,该反应常用于焊接钢轨。请写出该反应的化学方程式 。该反应中单质铝与一氧化碳有相似的 (填“氧化”或“还原”)性。
实验后同学们对金属与金属氧化物间的反应产生兴趣,激发了探究热情。
【提出问题】任何金属与金属氧化物在高温条件下都能反应吗?
同学们在请教老师后设计了如下实验方案并进行了探究。
【实验方案】
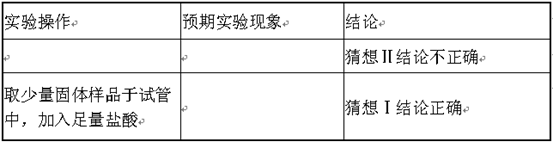
| 实验组别 | 实验操作 | 实验现象 | 结论 |
| 实验1 | 取Zn、CuO粉末的均匀混合物于密闭容器中,高温加热。 向冷却后的固体中加入足量的稀盐酸。 | 黑色粉末变成 色 固体部分溶解,有气泡产生,水溶液呈无色。 | Zn和CuO能发生置换反应。 |
| 实验2 | 取Mg、CuO粉末的均匀混合物于密闭容器中,高温加热。 向冷却后的固体中加入足量的稀盐酸。 | 发生爆炸,黑色粉末变成红色。 固体部分溶解,有气泡产生,水溶液呈 色。 | |
| 实验3 | 取Cu、Fe2O3粉末的均匀混合物于密闭容器中,高温加热。 | 粉末无变化 | Cu、Fe2O3不能反应。 |
【反思拓展】金属与金属氧化物在高温条件下反应的规律和金属与 的反应相似。
(12分)实验一 (1)2NaOH+CO2=Na2CO3+H2O
(2)证明二氧化碳已被完全吸收 干燥一氧化碳气体
(3)红色粉末变成黑色 (4) 证明反应生成了二氧化碳 尾气处理
实验二
2Al+Fe2O3 2Fe+Al2O3 还原 红 无
2Fe+Al2O3 还原 红 无
镁与氧化铜能发生置换反应 盐溶液
(2)证明二氧化碳已被完全吸收 干燥一氧化碳气体
(3)红色粉末变成黑色 (4) 证明反应生成了二氧化碳 尾气处理
实验二
2Al+Fe2O3
 2Fe+Al2O3 还原 红 无
2Fe+Al2O3 还原 红 无 镁与氧化铜能发生置换反应 盐溶液
分析:实验一:
(1)氢氧化钠溶液吸收二氧化碳生成二氧化碳与水;
(2)澄清石灰水遇二氧化碳变浑浊,可用来检验二氧化碳的存在;浓硫酸具有很好的吸水性;
(3)根据一氧化碳还原氧化铁的生成物考虑;
(4)澄清石灰水遇二氧化碳变浑浊,可用来检验二氧化碳的存在;
实验二:
实验装置如下图:根据铝粉和氧化铁粉末在高温条件下的反应叫铝热反应,属于置换反应,写出化学反应式;一氧化碳具有还原性;
实验方案:实验1:根据结论:Zn和CuO能发生置换反应.填写实验现象;
实验2:根据现象写出结论.
解:实验一
(1)根据化学方程式: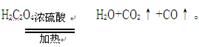
可知,有CO2生成,B装置中的氢氧化钠溶液可以吸收二氧化碳气体,化学反应式是:2NaOH+CO2=Na2CO3+H2O.
故答案为:2NaOH+CO2=Na2CO3+H2O;
(2)C装置中的澄清石灰水遇二氧化碳变浑浊,而C装置中无明显现象,说明二氧化碳已被氢氧化钠溶液完全吸收;D装置中浓硫酸的作用是吸收制取CO过程中产生的水,得到干燥的CO;
故答案为:证明二氧化碳已被完全吸收、干燥一氧化碳气体;
(3)E装置中的氧化铁在CO的还原作用下,由红色的氧化铁粉末变成黑色的铁粉.
故答案为:红色粉末变成黑色;
(4)F装置中的澄清石灰水遇二氧化碳变浑浊,可以用来证明二氧化碳的存在;点燃尾气,是因为过量的有毒一氧化碳会污染空气,所以要进行尾气处理.
故答案为:证明反应生成了二氧化碳、尾气处理;
实验二
实验装置如下图:铝粉和氧化铁粉末在高温条件下的反应叫铝热反应,属于置换反应,我们可以据此写出化学反应式:2Al+Fe2O3 2Fe+Al2O3,一氧化碳具有还原性,是在化学反应中得到氧的物质,在该反应中铝也是得到氧的物质,所以具有还原性.
2Fe+Al2O3,一氧化碳具有还原性,是在化学反应中得到氧的物质,在该反应中铝也是得到氧的物质,所以具有还原性.
故答案为:2Al+Fe2O3 2Fe+Al2O3、还原;
2Fe+Al2O3、还原;
实验方案:
实验1:根据结论:Zn和CuO能发生置换反应,说明置换出铜单质.故实验现象是:黑色粉末变成红色.
故答案为:红;
实验2:根据现象:发生爆炸,黑色粉末变成红色,说明氧化铜变成了铜单质,镁与氧化铜发生了置换反应.
故答案为:无、镁与氧化铜发生了置换反应;
反思拓展:金属与金属氧化物在高温条件下反应的规律是:活动性较强的金属可以将其后面的金属从它们的氧化物中置换出来,与金属与盐溶液的反应相似.故答案为:盐溶液.
点评:本题以实验探究的形式考查如何得到纯净的一氧化碳,以及实验设计等问题,要同学们具有综合的化学知识,再可做好此题.此题难度较大.
(1)氢氧化钠溶液吸收二氧化碳生成二氧化碳与水;
(2)澄清石灰水遇二氧化碳变浑浊,可用来检验二氧化碳的存在;浓硫酸具有很好的吸水性;
(3)根据一氧化碳还原氧化铁的生成物考虑;
(4)澄清石灰水遇二氧化碳变浑浊,可用来检验二氧化碳的存在;
实验二:
实验装置如下图:根据铝粉和氧化铁粉末在高温条件下的反应叫铝热反应,属于置换反应,写出化学反应式;一氧化碳具有还原性;
实验方案:实验1:根据结论:Zn和CuO能发生置换反应.填写实验现象;
实验2:根据现象写出结论.
解:实验一
(1)根据化学方程式:
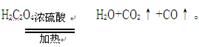
可知,有CO2生成,B装置中的氢氧化钠溶液可以吸收二氧化碳气体,化学反应式是:2NaOH+CO2=Na2CO3+H2O.
故答案为:2NaOH+CO2=Na2CO3+H2O;
(2)C装置中的澄清石灰水遇二氧化碳变浑浊,而C装置中无明显现象,说明二氧化碳已被氢氧化钠溶液完全吸收;D装置中浓硫酸的作用是吸收制取CO过程中产生的水,得到干燥的CO;
故答案为:证明二氧化碳已被完全吸收、干燥一氧化碳气体;
(3)E装置中的氧化铁在CO的还原作用下,由红色的氧化铁粉末变成黑色的铁粉.
故答案为:红色粉末变成黑色;
(4)F装置中的澄清石灰水遇二氧化碳变浑浊,可以用来证明二氧化碳的存在;点燃尾气,是因为过量的有毒一氧化碳会污染空气,所以要进行尾气处理.
故答案为:证明反应生成了二氧化碳、尾气处理;
实验二
实验装置如下图:铝粉和氧化铁粉末在高温条件下的反应叫铝热反应,属于置换反应,我们可以据此写出化学反应式:2Al+Fe2O3
 2Fe+Al2O3,一氧化碳具有还原性,是在化学反应中得到氧的物质,在该反应中铝也是得到氧的物质,所以具有还原性.
2Fe+Al2O3,一氧化碳具有还原性,是在化学反应中得到氧的物质,在该反应中铝也是得到氧的物质,所以具有还原性.故答案为:2Al+Fe2O3
 2Fe+Al2O3、还原;
2Fe+Al2O3、还原;实验方案:
实验1:根据结论:Zn和CuO能发生置换反应,说明置换出铜单质.故实验现象是:黑色粉末变成红色.
故答案为:红;
实验2:根据现象:发生爆炸,黑色粉末变成红色,说明氧化铜变成了铜单质,镁与氧化铜发生了置换反应.
故答案为:无、镁与氧化铜发生了置换反应;
反思拓展:金属与金属氧化物在高温条件下反应的规律是:活动性较强的金属可以将其后面的金属从它们的氧化物中置换出来,与金属与盐溶液的反应相似.故答案为:盐溶液.
点评:本题以实验探究的形式考查如何得到纯净的一氧化碳,以及实验设计等问题,要同学们具有综合的化学知识,再可做好此题.此题难度较大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目




 2MgO + C,所以镁着火不能用CO2来灭火。但没有找到有关钠能否与CO2反应的介绍。于是同学们展开钠着火能否用CO2来灭火的探究。
2MgO + C,所以镁着火不能用CO2来灭火。但没有找到有关钠能否与CO2反应的介绍。于是同学们展开钠着火能否用CO2来灭火的探究。