题目内容
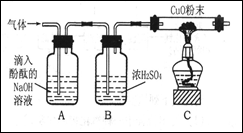
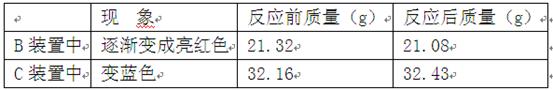
(5分)某校化学兴趣小组承担了某项研究课题的一部分:通过实验探究气体X(已知由两种元素组成)的元素组成。实验装置如下。将0.17gX气体由注射器A缓缓送入B装置(B装置中的空气已预先除去),使之完全反应,生成的气体全部用D装置抽取收集。实验的现象和数据记录如下:

(1)参加反应的氧元素的质量是 g,X中一定有 元素。
(2)经测定,D中的气体由一种元素组成,常温常压下密度是1.25g/L,试推测该气体的化学式是 ,其质量是 g。(常见气体密度如下)

(3)写出B装置中发生反应的化学方程式 。


(1)参加反应的氧元素的质量是 g,X中一定有 元素。
(2)经测定,D中的气体由一种元素组成,常温常压下密度是1.25g/L,试推测该气体的化学式是 ,其质量是 g。(常见气体密度如下)

(3)写出B装置中发生反应的化学方程式 。
(5分)(1)0.24 氢 (2) N2 0.14
(3)2NH3 + 3CuO ="==3Cu" + 3H2O + N2 (每空1分,共5分)
(3)2NH3 + 3CuO ="==3Cu" + 3H2O + N2 (每空1分,共5分)
分析:(1)装置B中CuO被还原,因失去氧而质量减小,根据质量守恒定律,参加反应氧元素的质量即装置B反应前后的质量差;根据实验中无水硫酸铜的颜色变化,确定反应生成了水,然后再根据化学变化前后元素不变的定律,完成对气体X的组成元素的判断;
(2)利用表中所给气体的密度与所测定的气体D的密度相对比,并由D中的气体由一种元素组成,完成对气体D的判断;根据质量守恒定律,由反应前后物质总质量差可计算生成的气体D的质量;
(3)根据对反应的分析,确定反应的反应物与生成物,根据化学方程式书原则及方法,完成化学方程式的书写.
解:(1)根据质量守恒定律,参加反应的氧元素的质量=21.32g-21.08g=0.24g;无水硫酸铜吸收了水装置C变蓝,说明气体X与氧化铜反应生成了水,根据反应前后元素不变,可判断气体X中含有氢元素;
(2)表中有两种气体CO和N2的密度都与气体D的常温常压下密度密度1.25g/L相同,若气体X为CO,与气体D中的气体由一种元素组成的测定结果相矛盾,因此可确定气体D为N2;根据质量守恒定律,生成D气体N2的质量=0.17g+21.32g+32.16g-21.08g-32.43g=0.14g;
(3)根据反应前后元素种类、质量都不变,及气体X由两种元素组成,可判断气体X是由N、H两元素组成的气体化合物,该气体中N、H元素的质量比=0.14g:(32.43-32.16-0.24)g=14:3,则N、H元素的原子个数比=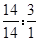 =1:3,气体X的化学式可表示为NH3;
=1:3,气体X的化学式可表示为NH3;
综合以上分析,装置B中反应为NH3与CuO在加热条件下发生反应,生成红色Cu、H2O和气体N2,反应的化学方程式为2NH3+3CuO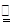 3Cu+3H2O+N2;
3Cu+3H2O+N2;
故答案为:(1)0.24;氢;(2)N2;0.14;(3)2NH3+3CuO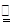 3Cu+3H2O+N2.
3Cu+3H2O+N2.
点评:本题涉及到较多的基础知识和基本的理论和规律,需要具有较强的分析及运算推理的能力.
(2)利用表中所给气体的密度与所测定的气体D的密度相对比,并由D中的气体由一种元素组成,完成对气体D的判断;根据质量守恒定律,由反应前后物质总质量差可计算生成的气体D的质量;
(3)根据对反应的分析,确定反应的反应物与生成物,根据化学方程式书原则及方法,完成化学方程式的书写.
解:(1)根据质量守恒定律,参加反应的氧元素的质量=21.32g-21.08g=0.24g;无水硫酸铜吸收了水装置C变蓝,说明气体X与氧化铜反应生成了水,根据反应前后元素不变,可判断气体X中含有氢元素;
(2)表中有两种气体CO和N2的密度都与气体D的常温常压下密度密度1.25g/L相同,若气体X为CO,与气体D中的气体由一种元素组成的测定结果相矛盾,因此可确定气体D为N2;根据质量守恒定律,生成D气体N2的质量=0.17g+21.32g+32.16g-21.08g-32.43g=0.14g;
(3)根据反应前后元素种类、质量都不变,及气体X由两种元素组成,可判断气体X是由N、H两元素组成的气体化合物,该气体中N、H元素的质量比=0.14g:(32.43-32.16-0.24)g=14:3,则N、H元素的原子个数比=
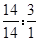 =1:3,气体X的化学式可表示为NH3;
=1:3,气体X的化学式可表示为NH3;综合以上分析,装置B中反应为NH3与CuO在加热条件下发生反应,生成红色Cu、H2O和气体N2,反应的化学方程式为2NH3+3CuO
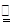 3Cu+3H2O+N2;
3Cu+3H2O+N2;故答案为:(1)0.24;氢;(2)N2;0.14;(3)2NH3+3CuO
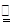 3Cu+3H2O+N2.
3Cu+3H2O+N2.点评:本题涉及到较多的基础知识和基本的理论和规律,需要具有较强的分析及运算推理的能力.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目