题目内容
(6分)碳酸氢钠常用于食品和医药工业、某化学兴趣小组对碳酸氢钠的热稳定性
进行探究。
[查阅资料]碳酸氢钠受热易完全分解,生成水、二氧化碳气体和一种常见固体物质,该固体物质含有三种元素,且为纯净物。
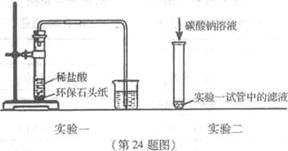
[进行实验一]为了验证碳酸氢钠受热时会分解,该兴趣小组的同学取一定质量的碳酸氢钠放到铜片上加热,如图1 6所示。
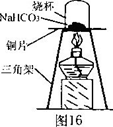
加热一段时间后,观察小烧杯内壁有_______________现象,证明有水生成;通过
_________证明有CO2生成。
[提出问题]碳酸氢钠充分加热后固体产物是什么?
[作出猜想]猜想Ⅰ:固体产物是Na2CO3
猜想Ⅱ:_____________________(请完成猜想Ⅱ)。
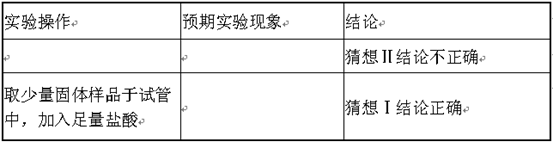
[进行实验二]下表是该兴趣小组同学设计的实验方案,用来检验碳酸氢钠分解后固体产物的成分。请你完成方案:
[拓展应用]碳酸氢钠常用来治疗胃酸过多,但对于患有胃溃疡(胃黏膜溃烂)的病人在胃酸(可用盐酸表示)过多时,却不宜服用碳酸氢钠,其原因是_______________________(用化学方程式表示)。
进行探究。
[查阅资料]碳酸氢钠受热易完全分解,生成水、二氧化碳气体和一种常见固体物质,该固体物质含有三种元素,且为纯净物。
[进行实验一]为了验证碳酸氢钠受热时会分解,该兴趣小组的同学取一定质量的碳酸氢钠放到铜片上加热,如图1 6所示。

加热一段时间后,观察小烧杯内壁有_______________现象,证明有水生成;通过
_________证明有CO2生成。
[提出问题]碳酸氢钠充分加热后固体产物是什么?
[作出猜想]猜想Ⅰ:固体产物是Na2CO3
猜想Ⅱ:_____________________(请完成猜想Ⅱ)。
[进行实验二]下表是该兴趣小组同学设计的实验方案,用来检验碳酸氢钠分解后固体产物的成分。请你完成方案:

[拓展应用]碳酸氢钠常用来治疗胃酸过多,但对于患有胃溃疡(胃黏膜溃烂)的病人在胃酸(可用盐酸表示)过多时,却不宜服用碳酸氢钠,其原因是_______________________(用化学方程式表示)。
水雾
NaOH(或其他合理答案)
将少量固体溶于水后 没有放出热量(或其他合理答案)
有气泡冒出 NaHCO3+HCl==NaCl+H2O+CO2↑
NaOH(或其他合理答案)
将少量固体溶于水后 没有放出热量(或其他合理答案)
有气泡冒出 NaHCO3+HCl==NaCl+H2O+CO2↑
分析:[进行实验一]根据碳酸氢钠受热能生成水分析;
[作出猜想]猜想Ⅱ:根据质量守恒定律,化学反应前后元素的种类不变进行解答;
[进行实验二]根据溶于水后是否放出大量的热判断是不是氢氧化钠,加入稀盐酸后看是否有气泡冒出来判断碳酸钠;
[拓展应用]根据质量守恒定律判断.
解答:解:[进行实验一]碳酸氢钠受热能生成水,故烧杯内壁有水珠出现,故答案为:水珠
[作出猜想]猜想Ⅱ:根据质量守恒定律,化学反应前后元素的种类不变,可以猜想为 NaOH,故答案为:NaOH
[进行实验二]根据溶于水后是否放出大量的热判断是不是氢氧化钠,加入稀盐酸后看是否有气泡冒出来判断碳酸钠,故答案为:
[拓展应用]根据质量守恒定律,碳酸氢钠与盐酸反应生成氯化钠、水和二氧化碳,故答案为:NaHCO3+HCl═NaCl+H2O+CO2↑
[作出猜想]猜想Ⅱ:根据质量守恒定律,化学反应前后元素的种类不变进行解答;
[进行实验二]根据溶于水后是否放出大量的热判断是不是氢氧化钠,加入稀盐酸后看是否有气泡冒出来判断碳酸钠;
[拓展应用]根据质量守恒定律判断.
解答:解:[进行实验一]碳酸氢钠受热能生成水,故烧杯内壁有水珠出现,故答案为:水珠
[作出猜想]猜想Ⅱ:根据质量守恒定律,化学反应前后元素的种类不变,可以猜想为 NaOH,故答案为:NaOH
[进行实验二]根据溶于水后是否放出大量的热判断是不是氢氧化钠,加入稀盐酸后看是否有气泡冒出来判断碳酸钠,故答案为:
| 实验操作 | 预期实验现象 | 结论 |
| 取少量固体样品溶于水 | 没有放出热量 | 猜想Ⅱ结论不正确 |
| 取少量固体样品于试管中,加入足量盐酸 | 有气泡冒出 | 猜想Ⅰ结论正确 |

练习册系列答案
相关题目