题目内容
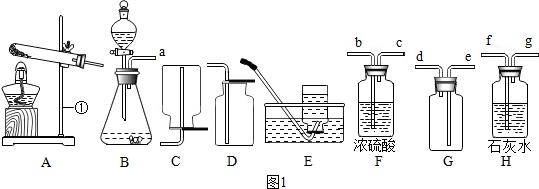
5.结合如图所示的实验装置回答有关问题.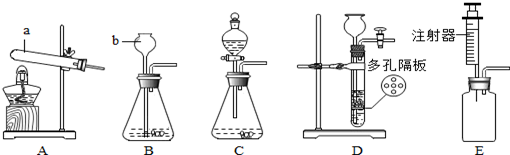
(1)写出装置中编号仪器的名称:a试管,b长颈漏斗;
(2)用氯酸钾制取氧气可选用的发生装置为A,反应的化学方程式为2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑,可用排水法收集氧气的原因是氧气不易溶于水.小明同学用排水法未能收集到两瓶氧气,其可能的原因有AB(填序号);
A.没有塞紧橡皮塞 B.没有及时更换收集第二瓶 C.加热前已将集气瓶灌满水倒立于水槽中
(3)用块状大理石和稀盐酸制取二氧化碳时,选择发生装置D的优点是可以控制反应的发生与停止,检验二氧化碳是否收集满的方法是燃着的木条放在集气瓶口,如果熄灭,证明已满;
(4)为了得到稳定的气流,实验室用过氧化氢溶液制氧气时应选择C或E装置.(5)若向(4)中所选装置中加入98克过氧化氢溶液和2克二氧化锰,等质量不再改变时称量反应后剩余物质总质量为96.8克,则生成氧气3.2克,需要过氧化氢的物质的量为0.2mol(要求写出计算过程).
反思:若操作无误称量准确,上述装置实际减少的质量=(填<、>、=)氧气质量.
分析 (1)熟记常见仪器的名称;
(2)氯酸钾在二氧化锰的催化作用下,受热分解生成氯化钾和氧气,氧气不易溶于水;如果操作不当,会影响实验;
(3)从D装置可以控制反应的发生与停止;而B装置中大理石与稀盐酸不能分离,不能控制反应的停止;二氧化碳的验满方法去分析;
(4)分液漏斗、注射器可控制双氧水的滴加速度,从而可控制反应速度;
(5)利用质量守恒定律即可求得氧气的量.最后利用所求氧气的质量求出过氧化氢溶液中溶质过氧化氢的质量以及物质的量.
解答 解:(1)a是试管,b是长颈漏斗;故答案为:试管;长颈漏斗;
(2)用氯酸钾(固体)在二氧化锰(固体)制取氧气时需要加热,可选用的发生装置为A装置;可用排水法收集氧气的原因是氧气不易溶于水;没有塞紧橡皮塞、没有及时更换收集第二瓶可能会导致未能收集到两瓶氧气.故填:A;2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑;氧气不易溶于水;AB.
(3)在D装置中,把大理石放在隔板上,稀盐酸通过长颈漏斗加入,使用时,让稀盐酸与大理石接触,反应开始,产生气体;不用时,可把导气管用止水夹夹住,产生的气体不能导出试管,造成试管内气体越来越多,压强越来越大,稀盐酸被压到长颈漏斗中,大理石和稀盐酸分离,反应停止,故C装置可以控制反应的发生与停止;而B装置中大理石与稀盐酸不能分离,不能控制反应的停止;二氧化碳的验满方法是:燃着的木条放在集气瓶口,如果熄灭,证明已满.故答案为:可以控制反应的发生与停止;燃着的木条放在集气瓶口,如果熄灭,证明已满;
(4)要得到平稳的气流,需控制双氧水的滴加速度,因此装置选择BG;故答案为:C或E;
(5)根据质量守恒定律可知,生成氧气的质量为:98g+2g-96.8g=3.2g;故填:3.2;
设生成3.2g氧气需要过氧化氢的质量为x,则
2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑
68 32
x 3.2g
$\frac{68}{32}=\frac{x}{3.2g}$
x=6.8g
过氧化氢的物质的量=$\frac{6.8g}{34g/mol}$=0.2mol
实验过程中,只生成了氧气这一种气体,所以若操作无误称量准确,上述装置实际减少的质量就等于生成氧气的质量.故填:0.2mol;=.
点评 本考点主要考查了仪器的名称、气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写和有关化学方程式的计算等,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.

 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案| A. | 五氧化二磷─白色固体 | B. | 氧化镁─白色固体 | ||
| C. | 四氧化三铁─黑色固体 | D. | 双氧水─白色固体 |
| A. | 木炭在氧气中燃烧,发出白色火焰,生成二氧化碳 | |
| B. | 铁在氧气中燃烧,火星四射,生成黑色固体 | |
| C. | 红磷在氧气中燃烧产生大量白烟 | |
| D. | 加热铜绿时,绿色粉末逐渐变为黑色 |
| 物质 | X | Y | Z | W |
| 反应前质量/g | 10 | 3 | 90 | 0 |
| 反应后质量/g | 3.2 | 3 | 待测 | 3.2 |
| A. | 反应中X和W的质量变化比为 17:8 | B. | Y可能是催化剂 | ||
| C. | 该反应是分解反应 | D. | 反应后Z物质的质量为86.4g |