题目内容
15.在一定条件下,在一个密闭容器内发生某反应,测得反应过程中各物质的质量如下表示,下列说法不正确的是( )| 物质 | X | Y | Z | W |
| 反应前质量/g | 10 | 3 | 90 | 0 |
| 反应后质量/g | 3.2 | 3 | 待测 | 3.2 |
| A. | 反应中X和W的质量变化比为 17:8 | B. | Y可能是催化剂 | ||
| C. | 该反应是分解反应 | D. | 反应后Z物质的质量为86.4g |
分析 根据质量守恒定律,参加反应前各物质的质量总和=反应后生成各物质的质量总和,结合表格中的数值,则待测值;从而判断反应物,生成物;再判定反应类型;掌握催化剂的“一变二不变”的特点
解答 解:设待测值为X,根据质量守恒定律,参加反应前各物质的质量总和=反应后生成各物质的质量总和,结合表格中的数值,则10+3+90+0=3.2+3+X+3.2,解得X=93.6克.分析质量的变化:X质量减少,Y质量不变,Z质量增加,W质量增加.质量增加的为生成物,质量减少的为反应物.
A、反应中X和W的质量变化比为 (10-3.2):3.2=17:8,说法正确,故A正确;
B、Y质量不变,符合催化剂的“一变二不变”的特点,所以可能是催化剂,说法正确,故B正确;
C、X反应生成Z和W,反应符合“一变多”,所以该反应是分解反应,说法正确,故C正确;
D、根据质量守恒定律,解得反应后Z物质的质量为93.6克,所以说法不正确,故D错误.
故选D.
点评 本题是运用化学中的基本思想质量守恒思想,通过归纳不同物质或不同变化过程中相同点和不同点有效地寻找出它们之间的内在联系以及融合点和嫁接点,从而培养了学生的创新思维能力.

练习册系列答案
相关题目
6.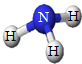 如图是某物质的分子模型,下列关于该物质说法正确的是( )
如图是某物质的分子模型,下列关于该物质说法正确的是( )
 如图是某物质的分子模型,下列关于该物质说法正确的是( )
如图是某物质的分子模型,下列关于该物质说法正确的是( )| A. | 物质中含有四个原子 | B. | 氢元素的质量分数为5.9% | ||
| C. | 化学式为NH3 | D. | 氮元素和氢元素的质量比为3:1 |
3.某同学进行下列化学实验时,其数据和现象记录正确的是( )
| A. | 用托盘天平称取大理石2.01g | |
| B. | 用10mL量筒量取稀盐酸5mL | |
| C. | 氢氧化钠固体溶于水后溶液温度降低 | |
| D. | 氢气在空气中燃烧产生了淡蓝色火焰 |
10.下列物质中不能由金属与稀盐酸发生置换反应直接得到的是( )
| A. | ZnCl2 | B. | AlCl3 | C. | CuCl2 | D. | MgCl2 |
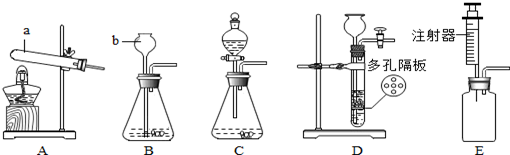
4.通过一段时间的化学学习,相信你已经掌握了实验室制取氧气的有关知识.请结合图示回答问题.

(1)写出图中标示的仪器名称:①酒精灯 ②集气瓶.
(2)实验室用氯酸钾和二氧化锰制取氧气:
写出该反应的化学方程式2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑,属于分解反应(填基本反应类型).若需要比较纯净的氧气用作铁丝燃烧实验,则收集装置最好选用F(填序号),运用以上收集装置的原因是做此实验时集气瓶底部要留少量水;防止溅落物炸裂瓶底.铁丝在氧气中燃烧的化学方程式3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4;实验现象剧烈燃烧,火星四射,放出大量的热,生成一种黑色固体.
(4)小珍阅读课外资料得知:用氯酸钾制取氧气时,除了用二氧化锰还可用氧化铜等物质作催化剂,于是她对氧化铜产生了探究兴趣.
【提出问题】氧化铜是否也能作氯酸钾分解的催化剂?它是否比二氧化锰催化效果更好?
【查阅资料】二氧化锰、氧化铜均为不溶于水的黑色粉末.
【设计实验】小珍以生成等体积的氧气为标准,设计了下列三组实验:
(其它可能影响实验的因素均忽略).
Ⅰ、上述实验应测量的“待测数据”是收集等量氧气所需时间.
Ⅱ、若实验②比实验①的“待测数据”更小(填“大”或“小”),说明氧化铜能加快氯酸钾的分解速率.
【质疑】这样能说明氧化铜是氯酸钾分解的催化剂吗?
【预期结论】不能.
【设计实验】将实验②反应后的固体加水充分溶解、过滤、洗涤、干燥、称量,此过程中需要用到的玻璃仪器有烧杯、漏斗、玻璃棒,第二步操作时耗时较长的原因可能是操作不规范.
若最终称量得到0.5g黑色粉末,应再将黑色粉末放入试管中,向试管中倒入适量的氯酸钾,混合均匀后加热,产生使带火星的木条复燃的气体(简述操作和现象).
【结论】氧化铜能作氯酸钾的催化剂.
【评价设计】你认为小珍设计实验③和实验②对比的目的是探究氧化铜和二氧化锰哪一个催化效果好.
(3)若用图I装置收集较为干燥的氧气,如何验满?将带火星的木条放在集气瓶口,如果复燃,说明收集满了.
(4)实验室用装置E制取氧气,如用注射器C替换长颈漏斗,优点是能够控制反应速率.
(5)注射器C也可用于检查装置E的气密性,步骤如下:
Ⅰ、向锥形瓶中加入少量水,使长颈漏斗插入液面以下.Ⅱ、将注射器C连接到装置E的导管口处.Ⅲ、缓慢拉动注射器C的活塞,观察到长颈漏斗下端形成一段水柱,表示装置E的气密性良好.

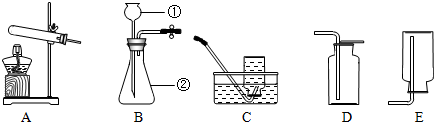
(1)写出图中标示的仪器名称:①酒精灯 ②集气瓶.
(2)实验室用氯酸钾和二氧化锰制取氧气:
写出该反应的化学方程式2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑,属于分解反应(填基本反应类型).若需要比较纯净的氧气用作铁丝燃烧实验,则收集装置最好选用F(填序号),运用以上收集装置的原因是做此实验时集气瓶底部要留少量水;防止溅落物炸裂瓶底.铁丝在氧气中燃烧的化学方程式3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4;实验现象剧烈燃烧,火星四射,放出大量的热,生成一种黑色固体.
(4)小珍阅读课外资料得知:用氯酸钾制取氧气时,除了用二氧化锰还可用氧化铜等物质作催化剂,于是她对氧化铜产生了探究兴趣.
【提出问题】氧化铜是否也能作氯酸钾分解的催化剂?它是否比二氧化锰催化效果更好?
【查阅资料】二氧化锰、氧化铜均为不溶于水的黑色粉末.
【设计实验】小珍以生成等体积的氧气为标准,设计了下列三组实验:
| 实验序号 | 氯酸钾质量 | 其它物质质量 | 待测数据 |
| ① | 1.2g | / | |
| ② | 1.2g | 氧化铜0.5g | |
| ③ | 1.2g | 二氧化锰0.5g |
Ⅰ、上述实验应测量的“待测数据”是收集等量氧气所需时间.
Ⅱ、若实验②比实验①的“待测数据”更小(填“大”或“小”),说明氧化铜能加快氯酸钾的分解速率.
【质疑】这样能说明氧化铜是氯酸钾分解的催化剂吗?
【预期结论】不能.
【设计实验】将实验②反应后的固体加水充分溶解、过滤、洗涤、干燥、称量,此过程中需要用到的玻璃仪器有烧杯、漏斗、玻璃棒,第二步操作时耗时较长的原因可能是操作不规范.
若最终称量得到0.5g黑色粉末,应再将黑色粉末放入试管中,向试管中倒入适量的氯酸钾,混合均匀后加热,产生使带火星的木条复燃的气体(简述操作和现象).
【结论】氧化铜能作氯酸钾的催化剂.
【评价设计】你认为小珍设计实验③和实验②对比的目的是探究氧化铜和二氧化锰哪一个催化效果好.
(3)若用图I装置收集较为干燥的氧气,如何验满?将带火星的木条放在集气瓶口,如果复燃,说明收集满了.
(4)实验室用装置E制取氧气,如用注射器C替换长颈漏斗,优点是能够控制反应速率.
(5)注射器C也可用于检查装置E的气密性,步骤如下:
Ⅰ、向锥形瓶中加入少量水,使长颈漏斗插入液面以下.Ⅱ、将注射器C连接到装置E的导管口处.Ⅲ、缓慢拉动注射器C的活塞,观察到长颈漏斗下端形成一段水柱,表示装置E的气密性良好.
5.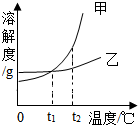 甲、乙两种物质溶解度曲线如图所示,下列叙述正确的是( )
甲、乙两种物质溶解度曲线如图所示,下列叙述正确的是( )
 甲、乙两种物质溶解度曲线如图所示,下列叙述正确的是( )
甲、乙两种物质溶解度曲线如图所示,下列叙述正确的是( )| A. | 依据溶解度曲线可判断:甲的溶解度比乙的大 | |
| B. | 将等质量的甲、乙的饱和溶液从t2℃降到t1℃,析出甲的质量大 | |
| C. | 将t2℃时甲的饱和溶液变为不饱和溶液,可采取降温的方法 | |
| D. | t2℃时,等质量的甲、乙饱和溶液中,溶质的质量相等 |
 如图是某药业公司生产的氯化钠注射液包装标签上的部分文字.请回答:
如图是某药业公司生产的氯化钠注射液包装标签上的部分文字.请回答: