��Ŀ����
����Ŀ����ˮ�����ƺ������ڹ�ӣ����н�Ϊ�ḻ��ˮ��Դ��
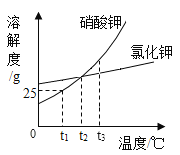
��1�����ˮ����________���� �������������������������
��2����ѧ�Ͽ��Բ���________���ⶨ��ˮ�����ȣ�����ĸ��ţ���
A ��̪��Һ
B ʯ����Һ
C pH��ֽ
��3��ij��ȤС����ʵ����ģ��ˮ���������ʵ��
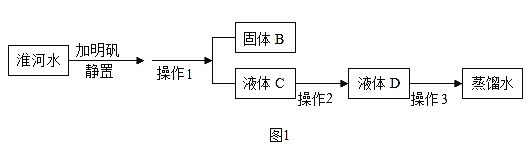
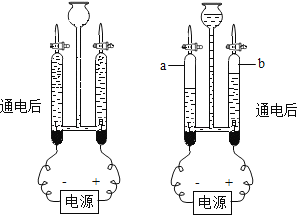
����ͼ����������������________��;
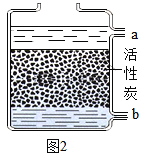
������ͼ2��ʾ��װ�ý��в���2,��������ˮӦ�ô�_______��ͨ�� ������a������b����,ʹˮ���������;
��ͨ������3���Եõ������̶Ƚϸߵ�����ˮ������3��������______��
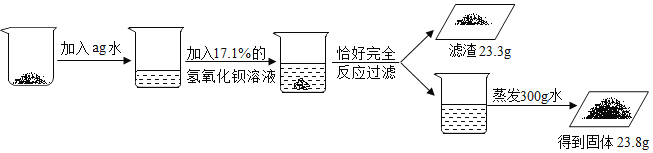
��4���ƺ�ӵ�зḻ����Դ����ͼΪ�Ӻ�ˮ����ȡ����þ�ļ�������ͼ��
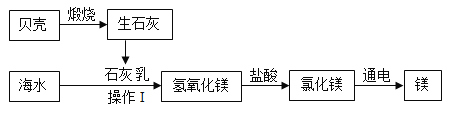
�ٺ����к�������������____________;
��ʵ�����н��в���1ʱ������IJ��������������������ձ���______________;
��д����������þ�����Ȼ�þ�Ļ�ѧ����ʽ______________;
�������������漰���Ļ�����Ӧ������______________�� ��
���𰸡������ C ���� b ���� ˮ����H2O�� ©�� ![]() 3
3
��������
��1�����ˮ�к���ˮ���������ʣ����ڻ����������
��2�����ָʾ��ֻ�ܲⶨ��Һ������ԣ�Ҫ�ⶨ��Һ��������Ҫ�õ�pH��ֽ�����C��
��3�����ھ���ˮ�Ĺ����У�������������������ˮ��������ˮ�е��������ʶ�������������Ӷ��������������������
������ͼ��ʾ��װ�ý��в���2���������û���̿�������ԣ���ȥ��ȥɫ�غ���ζ�����Ǵ�a��ͨ�룬���в����Ե�������ۼ��ڻ���̿�����棬�γ����࣬��ɶ������ʴ�������ˮӦ�ô�b��ͨ�룬��Ϊ�����ľ���Ч�����ã����b��
��������Գ�ȥˮ�е��������ʣ��Ǿ����̶���ߵľ���ˮ�ķ������������
��4����ˮ�Ǻ����к����������ʣ����ˮ����H2O����
�ڲ���1�Ƿ��������Թ�����Һ��ķ����������˲�����ʵ�����н��в���1ʱ������IJ��������������������ձ���©�������©����
�������������þ��Ӧ�����Ȼ�þ��ˮ����Ӧ�Ļ�ѧ����ʽΪ��Mg(OH)2+2HCl=MgCl2+2H2O�����Mg(OH)2+2HCl=MgCl2+2H2O��
���������֪����������������ʯ��ʯ��ͨ���Ȼ�þ�õ���þ�������˷ֽⷴӦ����ʯ��ת��Ϊʯ�����ǻ��Ϸ�Ӧ�������������Ȼ�þ��Ӧ��������þ��ϡ���ᷴӦ�Ǹ��ֽⷴӦ��δ�漰���Ļ�����Ӧ�������û���Ӧ�����3��