题目内容
(6分)水是最普通、最常见的物质之一。
(1)“水”有很多种。下列“水”属于纯净物的是 (填字母序号)。
A.河水 B.自来水 C.矿泉水 D.蒸馏水
(2) 电解水可证明水由氢、氧两种元素组成,该反应的化学方程式为 。
(3)水是重要的溶剂。
① 配制50 g溶质的质量分数为6%的氯化钠溶液。下列仪器中,能用到的是 。
A.蒸发皿 B.玻璃棒 C.烧杯 D.量筒
② 20℃时,NaCl的溶解度为36 g。该温度下,向盛有40g NaCl固体的烧杯中加入100 g水,充分溶解后,所得溶液中溶质与溶剂的质量比为 。
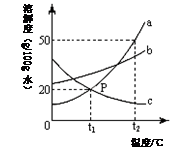
③ a、b、c三种物质的溶解度曲线如图所示。取等质量t2℃的a、b、c三种物质的饱和溶液,分别蒸发等量水后恢复至t2℃,析出溶质的质量 (用“﹥、﹤、﹦”连接“a、b、c”),若继续降温至t1℃,一定是饱和溶液的是 (用“a、b、c”表示)。

(1)“水”有很多种。下列“水”属于纯净物的是 (填字母序号)。
A.河水 B.自来水 C.矿泉水 D.蒸馏水
(2) 电解水可证明水由氢、氧两种元素组成,该反应的化学方程式为 。
(3)水是重要的溶剂。
① 配制50 g溶质的质量分数为6%的氯化钠溶液。下列仪器中,能用到的是 。
A.蒸发皿 B.玻璃棒 C.烧杯 D.量筒
② 20℃时,NaCl的溶解度为36 g。该温度下,向盛有40g NaCl固体的烧杯中加入100 g水,充分溶解后,所得溶液中溶质与溶剂的质量比为 。
③ a、b、c三种物质的溶解度曲线如图所示。取等质量t2℃的a、b、c三种物质的饱和溶液,分别蒸发等量水后恢复至t2℃,析出溶质的质量 (用“﹥、﹤、﹦”连接“a、b、c”),若继续降温至t1℃,一定是饱和溶液的是 (用“a、b、c”表示)。

(1)D(2)2H2O 通电 2H2↑+ O2↑(3)① BCD ② 9:25③ a>b=c a、b
试题分析:(1)A.河水B.自来水C.矿泉水等自然界中的水都属于混合物。D.蒸馏水属于纯净物。
(2) 电解水的化学方程式为2H2O 通电2H2↑+ O2↑。
(3)① 配制溶液需要的仪器:托盘天平、药匙、量筒、胶头滴管、烧杯、玻璃棒。所以应选BCD。
② 20℃时,NaCl的溶解度为36 g。即20℃时在100 g水中最多溶解NaCl为36 g。则所得溶液中溶质与溶剂的质量比为36 g:100 g=9:25
③ t2℃a、b、c三种物质的溶解度为:a>b=c。其饱和溶液的溶质质量分数为:
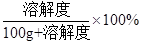 所以等质量的a、b、c三种物质的饱和溶液,分别蒸发等量水后恢复至t2℃,析出溶质的质量a>b=c。
所以等质量的a、b、c三种物质的饱和溶液,分别蒸发等量水后恢复至t2℃,析出溶质的质量a>b=c。若降温至t1℃,由于a、b两物质的溶解度均变小,所以其溶液一定是饱和溶液;c的溶解度变大,不一定为饱和溶液。

练习册系列答案
相关题目