题目内容
做完“二氧化碳的制取和性质”实验后,废液桶中有大量盐酸与氯化钙的混合溶液(不考虑其他杂质).为避免污染环境并回收利用废液,化学兴趣小组同学们做了如下实验:取废液桶中上层清液1044g,加入足量的CaCO3粉末,生成44g气体,过滤,得到a g滤液.向滤液中加入溶质质量分数为21.2%的碳酸钠溶液,所得溶液pH与加入的碳酸钠溶液的质量关系如下图所示.查阅资料:Na2CO3+CaCl2=CaCO3↓+2NaCl.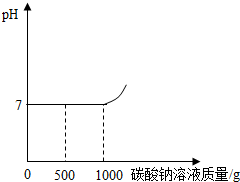
(1)a的值为
(2)加入1000g碳酸钠溶液后,溶液pH增大的原因是
(3)加入1000g碳酸钠溶液充分反应后,所得溶液能否用于生物兴趣小组的小麦选种(选种液要求氯化钠的质量分数在10%~20%之间)?请通过计算回答.
分析:(1)用所取的上层清液的质量+参加反应的碳酸钙的质量-生成的二氧化碳的质量即为所得滤液的质量,所取的上层清液的质量和二氧化碳的质量已知,参加反应的碳酸钙的质量可根据二氧化碳的质量求出.
(2)碳酸钠溶液显碱性,若碳酸钠溶液过量,溶液的PH会大于7.
(3)问所得溶液能否用于小麦选种,也就是要算出所得溶液中氯化钠的质量分数,看是否达到选种要求.所得溶液中氯化钠的质量分数=
×100%,氯化钠的质量可根据碳酸钠的质量求出,所得溶液的质量=滤液的质量+碳酸钠溶液的质量-沉淀的质量(可根据碳酸钠的质量求出).
(2)碳酸钠溶液显碱性,若碳酸钠溶液过量,溶液的PH会大于7.
(3)问所得溶液能否用于小麦选种,也就是要算出所得溶液中氯化钠的质量分数,看是否达到选种要求.所得溶液中氯化钠的质量分数=
| 氯化钠的质量 |
| 所得溶液的质量 |
解答:解:(1)设参加反应的碳酸钙的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 44g
=
x=100g
1044g+100g-44g=1100g.
故a的值为1100.
(2)碳酸钠溶液显碱性,若碳酸钠溶液过量,溶液的PH会大于7,故答案为:加入Na2CO3溶液过量,使溶液呈碱性,pH增大.
(3)设生成氯化钠的质量为y,碳酸钙的质量为z.
Na2CO3+CaCl2=2NaCl+CaCO3↓
106 117 100
1000g×21.2% y z
=212g
=
=
y=234g z=200g
所得溶液中氯化钠的质量分数为
×100%=12.3%
因为10%<12.3%<20%,所以可以用于生物兴趣小组的小麦选种.
答:可以用于生物兴趣小组的小麦选种.
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 44g
| 100 |
| 44 |
| x |
| 44g |
x=100g
1044g+100g-44g=1100g.
故a的值为1100.
(2)碳酸钠溶液显碱性,若碳酸钠溶液过量,溶液的PH会大于7,故答案为:加入Na2CO3溶液过量,使溶液呈碱性,pH增大.
(3)设生成氯化钠的质量为y,碳酸钙的质量为z.
Na2CO3+CaCl2=2NaCl+CaCO3↓
106 117 100
1000g×21.2% y z
=212g
| 106 |
| 212g |
| 117 |
| y |
| 106 |
| 212g |
| 100 |
| z |
y=234g z=200g
所得溶液中氯化钠的质量分数为
| 234g |
| 1100g+1000g-200g |
因为10%<12.3%<20%,所以可以用于生物兴趣小组的小麦选种.
答:可以用于生物兴趣小组的小麦选种.
点评:本题是一道比较复杂的根据化学方程式的计算题,题目内容比较烦琐,但只要将题目分析清楚,计算方法和过程还是学生经常见到的类型.

练习册系列答案
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案
相关题目
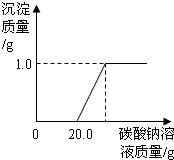 某班同学在做完“二氧化碳的制取和性质”实验后,废液缸中盛有大量的盐酸与氯化钙的混合溶液(不考虑其它杂质).为了对废液进行处理,某同学做了如下实验:取废液缸上层清液20.0g于烧杯中,逐滴滴入溶质质量分数为5.3%的碳酸钠溶液至过量,滴入碳酸钠溶液质量(/g)与生成沉淀的质量(/g)的变化关系如图所示.(计算结果精确到0.1%)
某班同学在做完“二氧化碳的制取和性质”实验后,废液缸中盛有大量的盐酸与氯化钙的混合溶液(不考虑其它杂质).为了对废液进行处理,某同学做了如下实验:取废液缸上层清液20.0g于烧杯中,逐滴滴入溶质质量分数为5.3%的碳酸钠溶液至过量,滴入碳酸钠溶液质量(/g)与生成沉淀的质量(/g)的变化关系如图所示.(计算结果精确到0.1%) 做完“二氧化碳的制取和性质”实验后,废液缸中盛有大量的盐酸与氯化钙的混合溶液(不考虑其他杂质).某同学处理废液时做了如下实验:取废液缸中上层清液于烧杯中,逐滴滴入Na2CO3溶液至过量.记录滴入Na2CO3溶液质量(x)与有关量的变化关系如图所示.下列判断正确的是( )
做完“二氧化碳的制取和性质”实验后,废液缸中盛有大量的盐酸与氯化钙的混合溶液(不考虑其他杂质).某同学处理废液时做了如下实验:取废液缸中上层清液于烧杯中,逐滴滴入Na2CO3溶液至过量.记录滴入Na2CO3溶液质量(x)与有关量的变化关系如图所示.下列判断正确的是( ) (2013?丰台区二模)做完“二氧化碳的制取和性质”实验后,废液桶中有大量盐酸与氯化钙的混合溶液(不考虑其他杂质).为避免污染环境并回收利用废液,化学兴趣小组同学们做了如下实验:取废液桶中上层清液522g,加入足量的CaCO3粉末,生成22g气体,过滤,得到a g滤液.向滤液中加入溶质质量分数为21.2%的碳酸钠溶液,所得溶液pH与加入的碳酸钠溶液的质量关系如图所示.查阅资料:Na2CO3+CaCl2=CaCO3↓+2NaCl.
(2013?丰台区二模)做完“二氧化碳的制取和性质”实验后,废液桶中有大量盐酸与氯化钙的混合溶液(不考虑其他杂质).为避免污染环境并回收利用废液,化学兴趣小组同学们做了如下实验:取废液桶中上层清液522g,加入足量的CaCO3粉末,生成22g气体,过滤,得到a g滤液.向滤液中加入溶质质量分数为21.2%的碳酸钠溶液,所得溶液pH与加入的碳酸钠溶液的质量关系如图所示.查阅资料:Na2CO3+CaCl2=CaCO3↓+2NaCl.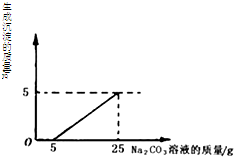 做完“二氧化碳的制取和性质”实验后,废液桶中有大量的盐酸与氯化钙的混合溶液(不考虑其他杂质).为避免污染环境并回收利用废液,同学们决定利用该废液,测定一种Na2CO3溶液中溶质的质量分数,于是向废液中慢慢滴加Na2CO3溶液,加入Na2CO3溶液的质量与生成沉淀质量的关系如右图所示.
做完“二氧化碳的制取和性质”实验后,废液桶中有大量的盐酸与氯化钙的混合溶液(不考虑其他杂质).为避免污染环境并回收利用废液,同学们决定利用该废液,测定一种Na2CO3溶液中溶质的质量分数,于是向废液中慢慢滴加Na2CO3溶液,加入Na2CO3溶液的质量与生成沉淀质量的关系如右图所示. (2013?北京模拟)在化学实验技能考试做完“二氧化碳的制取和性质”实验后,废液桶中有大量的盐酸与氯化钙的混合溶液(不考虑其他杂质).为避免污染环境并回收利用废液,化学兴趣小组做了如下实验:取废液10kg,向其中加入溶质质量分数为21.2%的碳酸钠溶液.所得溶液pH与加入的碳酸钠溶液的质量关系如图所示(已知:Na2CO3+CaCl2=CaCO3↓+2NaCl):
(2013?北京模拟)在化学实验技能考试做完“二氧化碳的制取和性质”实验后,废液桶中有大量的盐酸与氯化钙的混合溶液(不考虑其他杂质).为避免污染环境并回收利用废液,化学兴趣小组做了如下实验:取废液10kg,向其中加入溶质质量分数为21.2%的碳酸钠溶液.所得溶液pH与加入的碳酸钠溶液的质量关系如图所示(已知:Na2CO3+CaCl2=CaCO3↓+2NaCl):