题目内容
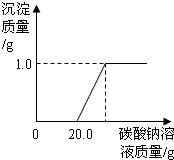 某班同学在做完“二氧化碳的制取和性质”实验后,废液缸中盛有大量的盐酸与氯化钙的混合溶液(不考虑其它杂质).为了对废液进行处理,某同学做了如下实验:取废液缸上层清液20.0g于烧杯中,逐滴滴入溶质质量分数为5.3%的碳酸钠溶液至过量,滴入碳酸钠溶液质量(/g)与生成沉淀的质量(/g)的变化关系如图所示.(计算结果精确到0.1%)
某班同学在做完“二氧化碳的制取和性质”实验后,废液缸中盛有大量的盐酸与氯化钙的混合溶液(不考虑其它杂质).为了对废液进行处理,某同学做了如下实验:取废液缸上层清液20.0g于烧杯中,逐滴滴入溶质质量分数为5.3%的碳酸钠溶液至过量,滴入碳酸钠溶液质量(/g)与生成沉淀的质量(/g)的变化关系如图所示.(计算结果精确到0.1%)求:(1)当废液中盐酸完全反应时,生成的二氧化碳的质量.
(2)实验过程中实际参加反应的碳酸钠溶液的质量为多少?
(3)当废液中两种物质刚好消耗完毕时,所得溶液中氯化钠的质量分数.
分析:(1)产生沉淀前消耗20.0g碳酸钠溶液,这是与废液中盐酸反应的碳酸钠溶液的质量,由于盐酸反应的碳酸钠溶液的质量和质量分数,根据二者反应的化学方程式可以计算出生成氯化钠和二氧化碳的质量.
(2)由沉淀质量碳酸钠溶液的质量分数,根据碳酸钠与氯化钙反应的化学方程式可以计算出与氯化钙反应的碳酸钠溶液的质量
和生成氯化钠的质量.两部分碳酸钠溶液合起来就是实际参加反应的碳酸钠溶液的质量.
(3)由两种反应生成的氯化钠的质量和除以所得溶液的质量就得到所得溶液中氯化钠的质量分数.
(2)由沉淀质量碳酸钠溶液的质量分数,根据碳酸钠与氯化钙反应的化学方程式可以计算出与氯化钙反应的碳酸钠溶液的质量
和生成氯化钠的质量.两部分碳酸钠溶液合起来就是实际参加反应的碳酸钠溶液的质量.
(3)由两种反应生成的氯化钠的质量和除以所得溶液的质量就得到所得溶液中氯化钠的质量分数.
解答:解:(1)设与盐酸反应时,生成氯化钠的质量为x,生成二氧化碳的质量为y.
Na2CO3+2HCl═2NaCl+CO2↑+H2O
106 117 44
20.0g×5.3% x y
=
=
x=1.17g,y=0.44g
(2)设与氯化钙反应时,需要碳酸钠溶液的质量为z,生成氯化钠的质量为w.
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 100 117
z?5.3% 1g w
=
=
z=20.0g,w=1.17g
实际参加反应的碳酸钠溶液的质量为
20.0g+20.0g=40.0g
(3)所得溶液中氯化钠的质量分数为
×100%≈4.0%
答:(1)生成二氧化碳0.44g.
(2)实际参加反应的碳酸钠溶液的质量为40.0g.
(3)所得溶液中氯化钠的质量分数为4.0%.
Na2CO3+2HCl═2NaCl+CO2↑+H2O
106 117 44
20.0g×5.3% x y
| 106 |
| 20.0g×5.3% |
| 117 |
| x |
| 44 |
| y |
x=1.17g,y=0.44g
(2)设与氯化钙反应时,需要碳酸钠溶液的质量为z,生成氯化钠的质量为w.
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 100 117
z?5.3% 1g w
| 106 |
| z?5.3% |
| 100 |
| 1g |
| 117 |
| w |
z=20.0g,w=1.17g
实际参加反应的碳酸钠溶液的质量为
20.0g+20.0g=40.0g
(3)所得溶液中氯化钠的质量分数为
| 1.17g+1.17g |
| 20.0g+40.0g-1g-0.44g |
答:(1)生成二氧化碳0.44g.
(2)实际参加反应的碳酸钠溶液的质量为40.0g.
(3)所得溶液中氯化钠的质量分数为4.0%.
点评:本题主要考查含杂质物质的化学方程式计算和溶质质量分数的计算,难度较大.

练习册系列答案
相关题目
某班同学在做完“二氧化碳的制取和性质”实验后,废液缸内盛有大量的盐酸与氯化钙的混合溶液(不考虑其他杂质).为了对废液进行探究,某小组同学进行了如下实验:取废液缸中的澄清溶液20g盛于烧杯中,逐滴加入5.3%的碳酸钠溶液使其完全反应.有关实验数据记录如下表.当碳酸钠溶液滴加至50g(已过量)时,将杯中物质进行过滤后得干燥固体1.0g.其他数据记录如下:
(1)求盐酸完全反应时生成的二氧化碳的质量.
(2)20g废液中含氯化氢的质量.
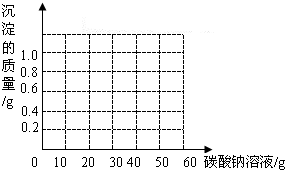
(3)请在右图中画出生成沉淀随加入Na2CO3溶液质量变化的曲线.
(4)当废液中两种物质刚好消耗完毕时,所得溶液中氯化钠的质量分数.
| 测定次数 | 第1次 | 第2次 | 第3次 | 第4次 | 第5次 |
| 加入Na2CO3溶液/g | 10.0 | 20.0 | 30.0 | 40.0 | 50.0 |
| 杯中物质的总质量/g | 29.78 | 39.56 | 49.56 | 59.56 | 未测 |
(2)20g废液中含氯化氢的质量.

(3)请在右图中画出生成沉淀随加入Na2CO3溶液质量变化的曲线.
(4)当废液中两种物质刚好消耗完毕时,所得溶液中氯化钠的质量分数.
 (2006?玄武区一模)某班同学在做完“二氧化碳的制取和性质”实验后,废液缸中盛有大量的盐酸与氯化钙的混合溶液(不考虑其他杂质).为了对废液进行处理,某同学做了如下实验:取废液缸中上层清液40mL于烧杯中,逐滴滴入Na2CO3溶液至过量.记录滴入Na2CO3溶液质量(x)与有关量的变化关系如图所示.图中纵坐标(y)表示
(2006?玄武区一模)某班同学在做完“二氧化碳的制取和性质”实验后,废液缸中盛有大量的盐酸与氯化钙的混合溶液(不考虑其他杂质).为了对废液进行处理,某同学做了如下实验:取废液缸中上层清液40mL于烧杯中,逐滴滴入Na2CO3溶液至过量.记录滴入Na2CO3溶液质量(x)与有关量的变化关系如图所示.图中纵坐标(y)表示 某班同学在做完“二氧化碳的制取和性质”实验后,废液缸中盛有大量的盐酸与氯化钙的混合溶液(不考虑其它杂质).为了对废液进行处理,某同学做了如下实验:取废液缸上层清液20.0g于烧杯中,逐滴滴入溶质质量分数为5.3%的碳酸钠溶液直至过量,滴入碳酸钠溶液的质量与生成沉淀的质量的变化关系如图所示.
某班同学在做完“二氧化碳的制取和性质”实验后,废液缸中盛有大量的盐酸与氯化钙的混合溶液(不考虑其它杂质).为了对废液进行处理,某同学做了如下实验:取废液缸上层清液20.0g于烧杯中,逐滴滴入溶质质量分数为5.3%的碳酸钠溶液直至过量,滴入碳酸钠溶液的质量与生成沉淀的质量的变化关系如图所示.