题目内容
在课堂中,同学们用硫酸、硝酸钡、氢氧化钠、碳酸钾四种物质的溶液,进行复分解反应发生条件的探究.(1)通过判断上述四种溶液两两之间能否发生反应,写出其中符合下列条件的化学方程式.
有沉淀生成的反应:______.
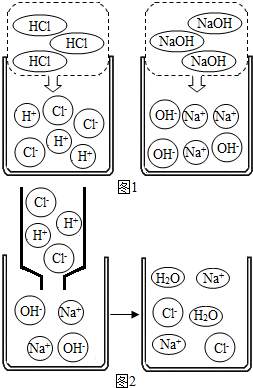
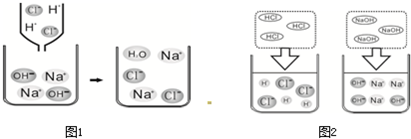
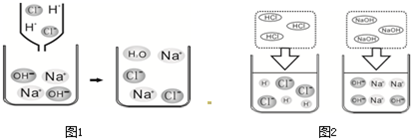
(2)下面图1是HCl和NaOH在水中解离的微观示意图;图2是稀盐酸和氢氧化钠反应的微观过程示意图.

①盐酸和氢氧化钠发生反应的微观实质是什么?______.
②通过课堂上的探究能发现:在溶液中,除了H+和OH-不能大量共存外,______(填两种离子符号)也不能大量共存.
(3)利用上述四种物质的溶液完成实验后,将所得物质混合并过滤,得到一种无色溶液.
①经测定,该溶液显酸性.则该溶液中一定含有的离子是______.(至少写4种离子符号)
②为验证该溶液中可能含有的离子是否存在,我设计如下实验进行验证.(验证一种离子即可)
| 溶液中可能含有的离子 | 设计实验验证(实验步骤、现象及对应的结论) |
| ______ | ______ |
【答案】分析:(1)根据四种物质中的离子生成的沉淀只有硫酸钡和碳酸钡进行分析解答.
(2)①根据中和反应的实质进行分析解答.
②根据复分解反应的条件,离子间若能互相结合成沉淀、气体或水,则离子不能共存.
(3)①根据题中的信息溶液显酸性、离子共存的条件进行分析解答.
②可能含有①Ba2+,②SO42-,③Ba2+或SO42-;为了验证该溶液中可能含有的离子是否存在,设计实验进行验证.
(4)根据稀盐酸与氢氧化钠反应生成氯化钠和水,由氢氧化钠溶液中溶质的质量的质量计算出反应后所得溶液中溶质氯化钠的质量,进而计算出所得溶液中溶质的质量分数即可.
解答:解:(1)四种物质之间会生成的沉淀只有碳酸钡沉淀和硫酸钡沉淀,所以化学方程式为:H2SO4+Ba(NO3)2=BaSO4↓+2HNO3或K2CO3+Ba(NO3)2=BaCO3↓+2KNO3.故答案为:H2SO4+Ba(OH)2=BaSO4↓+2H2O或K2CO3+Ba(NO3)2=BaCO3↓+2KNO3.
(2)根据是稀盐酸和氢氧化钠溶液发生化学反应的微观过程示意图,该化学反应的实质是氢离子和氢氧根离子生成水分子,可以表示为H++OH-=H2O.故答案为:氢离子和氢氧根离子生成水分子或H++OH-=H2O.
(3)在溶液中,Ba2+、SO42-两种离子能结合成硫酸钡沉淀,不能大量共存.故答案为:Ba2+ 和 SO42-.
(3)①根据题中的信息溶液显酸性,则溶液中一定有H+;通过物质的溶解性规律可知:所有的钾盐、钠盐、硝酸盐都溶于水,故溶液中一定含有的离子为:H+、Na+、K+和NO3-.
故答案为:K+、NO3-、H+、Na+;
②可能含有①Ba2+,②SO42-,③Ba2+或SO42-;如可能含有SO42-,取上述溶液少量于试管中,加入少量硝酸钡溶液;若出现白色沉淀,则说明上述溶液中含有SO42-;若没有出现白色沉淀,则说明上述溶液中不含有SO42-.
故答案为:SO42-;加入硝酸钡溶液,若有沉淀则含有该离子.
(4)解:100g溶质质量分数为16%的氢氧化钠溶液溶质的质量为100g×16%=16g.
设氯化钠的质量为x,
NaOH+HCl=NaCl+H2O
40 58.5
16g x
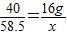 X=23.4g
X=23.4g
所得溶液溶质的质量分数=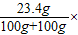 100%=11.7%.
100%=11.7%.
答:所得溶液溶质的质量分数为11.7%.
点评:本题难度不是很大,但综合性较强,理解复分解反应的条件及反应的实质、常见离子的检验方法、掌握根据化学方程式与溶质质量分数的综合计算是正确解答本题的关键.
(2)①根据中和反应的实质进行分析解答.
②根据复分解反应的条件,离子间若能互相结合成沉淀、气体或水,则离子不能共存.
(3)①根据题中的信息溶液显酸性、离子共存的条件进行分析解答.
②可能含有①Ba2+,②SO42-,③Ba2+或SO42-;为了验证该溶液中可能含有的离子是否存在,设计实验进行验证.
(4)根据稀盐酸与氢氧化钠反应生成氯化钠和水,由氢氧化钠溶液中溶质的质量的质量计算出反应后所得溶液中溶质氯化钠的质量,进而计算出所得溶液中溶质的质量分数即可.
解答:解:(1)四种物质之间会生成的沉淀只有碳酸钡沉淀和硫酸钡沉淀,所以化学方程式为:H2SO4+Ba(NO3)2=BaSO4↓+2HNO3或K2CO3+Ba(NO3)2=BaCO3↓+2KNO3.故答案为:H2SO4+Ba(OH)2=BaSO4↓+2H2O或K2CO3+Ba(NO3)2=BaCO3↓+2KNO3.
(2)根据是稀盐酸和氢氧化钠溶液发生化学反应的微观过程示意图,该化学反应的实质是氢离子和氢氧根离子生成水分子,可以表示为H++OH-=H2O.故答案为:氢离子和氢氧根离子生成水分子或H++OH-=H2O.
(3)在溶液中,Ba2+、SO42-两种离子能结合成硫酸钡沉淀,不能大量共存.故答案为:Ba2+ 和 SO42-.
(3)①根据题中的信息溶液显酸性,则溶液中一定有H+;通过物质的溶解性规律可知:所有的钾盐、钠盐、硝酸盐都溶于水,故溶液中一定含有的离子为:H+、Na+、K+和NO3-.
故答案为:K+、NO3-、H+、Na+;
②可能含有①Ba2+,②SO42-,③Ba2+或SO42-;如可能含有SO42-,取上述溶液少量于试管中,加入少量硝酸钡溶液;若出现白色沉淀,则说明上述溶液中含有SO42-;若没有出现白色沉淀,则说明上述溶液中不含有SO42-.
故答案为:SO42-;加入硝酸钡溶液,若有沉淀则含有该离子.
(4)解:100g溶质质量分数为16%的氢氧化钠溶液溶质的质量为100g×16%=16g.
设氯化钠的质量为x,
NaOH+HCl=NaCl+H2O
40 58.5
16g x
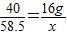 X=23.4g
X=23.4g所得溶液溶质的质量分数=
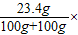 100%=11.7%.
100%=11.7%.答:所得溶液溶质的质量分数为11.7%.
点评:本题难度不是很大,但综合性较强,理解复分解反应的条件及反应的实质、常见离子的检验方法、掌握根据化学方程式与溶质质量分数的综合计算是正确解答本题的关键.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
在课堂中,同学们用硫酸、硝酸钡、氢氧化钠、碳酸钾四种物质的溶液,进行复分解反应发生条件的探究.
(1)通过判断上述四种溶液两两之间能否发生反应,写出其中符合下列条件的化学方程式.
有沉淀生成的反应:______.
(2)下面图1是HCl和NaOH在水中解离的微观示意图;图2是稀盐酸和氢氧化钠反应的微观过程示意图.
①盐酸和氢氧化钠发生反应的微观实质是什么?______.
②通过课堂上的探究能发现:在溶液中,除了H+和OH-不能大量共存外,______(填两种离子符号)也不能大量共存.
(3)利用上述四种物质的溶液完成实验后,将所得物质混合并过滤,得到一种无色溶液.
①经测定,该溶液显酸性.则该溶液中一定含有的离子是______.(至少写4种离子符号)
②为验证该溶液中可能含有的离子是否存在,我设计如下实验进行验证.(验证一种离子即可)
| 溶液中可能含有的离子 | 设计实验验证(实验步骤、现象及对应的结论) |
| ______ | ______ |
 (2011?乌鲁木齐)在高效复习课堂中,同学们利用“硫酸、硝酸钡、氢氧化钠、碳酸钾”四种物质的溶液对“复分解反应发生的条件”进行再探究.
(2011?乌鲁木齐)在高效复习课堂中,同学们利用“硫酸、硝酸钡、氢氧化钠、碳酸钾”四种物质的溶液对“复分解反应发生的条件”进行再探究.