题目内容
 (2011?乌鲁木齐)在高效复习课堂中,同学们利用“硫酸、硝酸钡、氢氧化钠、碳酸钾”四种物质的溶液对“复分解反应发生的条件”进行再探究.
(2011?乌鲁木齐)在高效复习课堂中,同学们利用“硫酸、硝酸钡、氢氧化钠、碳酸钾”四种物质的溶液对“复分解反应发生的条件”进行再探究.【知识回放】
通过判断上述四种溶液两两之间能否发生反应,我能写出其中符合下列条件的两个化学方程式:
(1)一个中和反应
H2SO4+2NaOH=Na2SO4+2H2O
H2SO4+2NaOH=Na2SO4+2H2O
;(2)一个有沉淀生成的反应
H2SO4+Ba(NO3)2=BaSO4↓+2HNO3或K2CO3+Ba(NO3)2=BaCO3↓+2KNO3
H2SO4+Ba(NO3)2=BaSO4↓+2HNO3或K2CO3+Ba(NO3)2=BaCO3↓+2KNO3
.【挖掘实质】
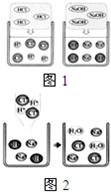
(1)图1是HCl和NaOH在水中解离出离子的示意图,我发现HCl在水中会解离出H+和Cl-,NaOH在水中会解离出Na+和OH-,以此类推硝酸钡在水中会解离出的离子是
Ba2+和NO3-
Ba2+和NO3-
(填离子符号).(2)图2是稀盐酸和氢氧化钠溶液发生化学反应的微观过程示意图,该化学反应的实质可以表示为H++OH-=H2O,我也能用同样的方式表示上述四种溶液两两之间发生反应时有气体生成的反应的实质
2H++CO32-=H2O+CO2↑
2H++CO32-=H2O+CO2↑
.(3)通过探究上述四种溶液两两之间是否发生反应的实质,我发现NaOH和H2SO4溶液能发生复分解反应,因为溶液中的H+和OH-不能大量共存;
H2SO4
H2SO4
溶液和Ba(NO3)2
Ba(NO3)2
溶液也可以发生复分解反应(任写一组物质,下同),因为Ba2+和SO42-在溶液中不能大量共存
Ba2+和SO42-在溶液中不能大量共存
;NaOH
NaOH
和K2CO3
K2CO3
溶液不能发生复分解反应,因为K+、CO32-、Na+和OH-
K+、CO32-、Na+和OH-
(填离子符号,下同)能大量共存.【知识升华】
通过对“复分解反应发生的条件”的再探究,我得出复分解反应发生条件的实质是
复分解反应的实质是离子交换的反应,只要反应物中某些离子浓度减小了(或不能大量共存),复分解反应就可以发生
复分解反应的实质是离子交换的反应,只要反应物中某些离子浓度减小了(或不能大量共存),复分解反应就可以发生
.分析:【知识回放】
(1)根据中和反应的定义进行分析,
(2)根据四种物质中的离子生成的沉淀只有硫酸钡和碳酸钡进行分析.
【挖掘实质】
(1)根据HCl在水中会解离出H+和Cl-,利用类比的思想分析硝酸钡离解出的离子,
(2)根据中和反应的实质就是氢离子和氢氧根离子中和反应,推导出有气体的反应,
(3)根据复分解反应实质就是离子之间生成水、沉淀、气体的反应来分析.
(1)根据中和反应的定义进行分析,
(2)根据四种物质中的离子生成的沉淀只有硫酸钡和碳酸钡进行分析.
【挖掘实质】
(1)根据HCl在水中会解离出H+和Cl-,利用类比的思想分析硝酸钡离解出的离子,
(2)根据中和反应的实质就是氢离子和氢氧根离子中和反应,推导出有气体的反应,
(3)根据复分解反应实质就是离子之间生成水、沉淀、气体的反应来分析.
解答:解:【知识回放】
(1)酸和见生成盐和水的反应就是中和反应,四种物质中只有硫酸是酸,氢氧化钠是碱,故答案为:①H2SO4+2NaOH=Na2SO4+2H2O
(2)②四种物质之间会生成的沉淀只有碳酸钡沉淀和硫酸钡沉淀,故答案为:H2SO4+Ba(NO3)2=BaSO4↓+2HNO3或K2CO3+Ba(NO3)2=BaCO3↓+2KNO3
【挖掘实质】
(1)钠元素是+1价,氢氧根是-1价,电离后生成Na+和OH-,钡 显+2价,硝酸根显-1价,故答案为:③Ba2+和NO3-
(4)中和反应的实质是:H++OH-=H2O,会生成二氧化碳的只有旅社碳酸钾,故答案为:④2H++CO32-=H2O+CO2↑
(3)根据NaOH和H2SO4溶液能发生复分解反应,因为溶液中的H+和OH-不能大量共存,采用类比的思想填后面的空白,故答案为:⑤H2SO4⑥Ba(NO3)2
⑦Ba2+和SO42-在溶液中不能大量共存
⑧NaOH⑨Ba(NO3)2或⑧NaOH⑨K2CO3
⑩K+、CO32-、Na+和OH-
(1)酸和见生成盐和水的反应就是中和反应,四种物质中只有硫酸是酸,氢氧化钠是碱,故答案为:①H2SO4+2NaOH=Na2SO4+2H2O
(2)②四种物质之间会生成的沉淀只有碳酸钡沉淀和硫酸钡沉淀,故答案为:H2SO4+Ba(NO3)2=BaSO4↓+2HNO3或K2CO3+Ba(NO3)2=BaCO3↓+2KNO3
【挖掘实质】
(1)钠元素是+1价,氢氧根是-1价,电离后生成Na+和OH-,钡 显+2价,硝酸根显-1价,故答案为:③Ba2+和NO3-
(4)中和反应的实质是:H++OH-=H2O,会生成二氧化碳的只有旅社碳酸钾,故答案为:④2H++CO32-=H2O+CO2↑
(3)根据NaOH和H2SO4溶液能发生复分解反应,因为溶液中的H+和OH-不能大量共存,采用类比的思想填后面的空白,故答案为:⑤H2SO4⑥Ba(NO3)2
⑦Ba2+和SO42-在溶液中不能大量共存
⑧NaOH⑨Ba(NO3)2或⑧NaOH⑨K2CO3
⑩K+、CO32-、Na+和OH-
点评:在解该题时,首先要理解透复分解反应的条件,然后就是整合题中有用的知识采用类比的思想解答.

练习册系列答案
相关题目
 (2011?乌鲁木齐)甲、乙两种固体的溶解度曲线如图所示:
(2011?乌鲁木齐)甲、乙两种固体的溶解度曲线如图所示: