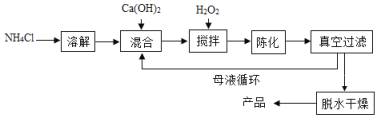
题目内容
【题目】分离水垢中的 CaCO3和Mg(OH)2,小林设计了如下实验流程(部分产物已略去):

(1)滤液A中含有的离子为_____;
(2)在沉淀C中加入MgCl2溶液的目的是_____;
(3)操作I和操作Ⅱ为_____。
【答案】钙离子、镁离子、氢离子、氯离子 除去沉淀C中的氢氧化钙 过滤
【解析】
(1)CaCO3和Mg(OH)2与过量的稀盐酸反应,分别生成氯化钙、水和二氧化碳,氯化镁和水,滤液A是氯化钙、氯化镁和盐酸的混合溶液,滤液中含有的离子为钙离子、镁离子、氢离子、氯离子。
(2)氢氧化钙能与氯化镁溶液反应生成氢氧化镁沉淀和氯化钙,氢氧化钙微溶于水,沉淀C中含有微溶于水的氢氧化钙,在沉淀C中加入MgCl2溶液的目的是除去沉淀C中的氢氧化钙。
(3)操作I和操作Ⅱ均是将沉淀与滤液分离,均为过滤操作。

练习册系列答案
相关题目
【题目】酸、碱、盐是我们身边重要的化合物,在生活和生产中具有广泛的应用。
(1)某锅炉水垢的主要成分有CaCO3、Mg(OH)2、Fe2O3,用“酸洗”法可除去该水垢。
①“酸洗”时,一般选用_____(填“稀硫酸”或“稀盐酸”);
②写出稀盐酸与氧化铁反应的化学方程式___________。
(2)两种抗胃酸药剂的主要成分及建议每次剂量见表:
主要成分 | NaHCO3 | Mg(OH)2 |
建议每次剂量/g | 0.5 | 0.3 |
每次服用Mg(OH)2的剂量比 NaHCO3“少”的原因是_____。