题目内容
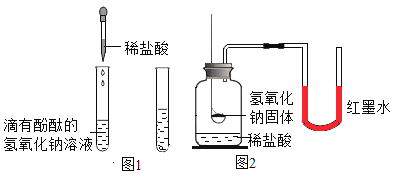
【题目】同学们在帮助老师整理实验室时,发现半瓶久置的氢氧化钙粉末[Ca(OH)2],大家决定用实验的方法探究这瓶粉末的组成。(资料:室温时,Ca(OH)2的溶解度是0.165g)
实验一:样品溶于水
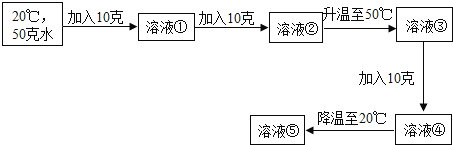
取一药匙的样品,加入20mL水中充分溶解后,有沉淀物。
(1)有同学认为,该沉淀物可能是氢氧化钙,其推断的理由应该是_____。
(2)要证明样品已经变质生成碳酸钙,可往分离出的沉淀物中滴加稀盐酸,反应的化学方程式为_____。
实验二:测定样品中碳酸钙的质量分数
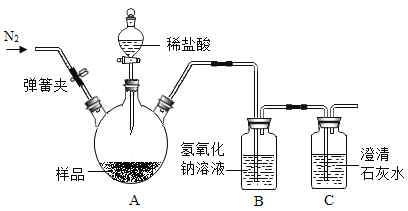
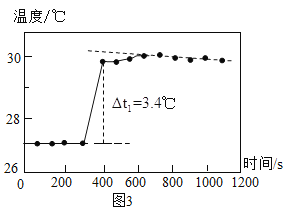
如图:打开弹簧夹,先通入N2一会儿,以排尽装置中含有的CO2.关闭弹簧夹,在A的样品中加入足量的稀盐酸。通过测定反应产生的二氧化碳气体的质量,可计算碳酸钙的质量分数(装置气密性已检验,夹持装置已省略)。
(3)装置B中发生反应的化学方程式是_____。
(4)实验结束后,还要再通一会儿N2,目的是_____。
(5)若C中无变化,经测定B瓶增重m g,要计算样品中碳酸钙的质量分数,还要预先测定_____的质量。
(6)若C中石灰水变浑浊,则测得的样品中CaCO3 的质量分数值将_____(填“偏高”、“偏低”或“不变”)。
【答案】室温时![]() 的溶解度是0.165g,溶解度很小
的溶解度是0.165g,溶解度很小 ![]()
![]() 使反应产生的二氧化碳全部被氢氧化钠溶液吸收 样品A 偏低
使反应产生的二氧化碳全部被氢氧化钠溶液吸收 样品A 偏低
【解析】
(1)由题干数据可知,室温时![]() 的溶解度是0.165g,溶解度很小,一药匙的氢氧化钙不能全部溶解在20mL水中,因此该沉淀物可能是氢氧化钙。
的溶解度是0.165g,溶解度很小,一药匙的氢氧化钙不能全部溶解在20mL水中,因此该沉淀物可能是氢氧化钙。
(2)碳酸钙和稀盐酸反应生成氯化钙、二氧化碳和水,反应的化学方程式为![]() 。
。
(3)装置B用来吸收二氧化碳,装置B中二氧化碳和氢氧化钠发生反应生成碳酸钠和水,反应的化学方程式为![]() 。
。
(4)若装置中残留有二氧化碳会影响到最终的结果,实验结束后,还要再通一会儿N2,目的是使反应产生的二氧化碳全部被氢氧化钠溶液吸收。
(5)B瓶增重的质量为碳酸钙与稀盐酸反应生成的二氧化碳的质量,根据方程式可以计算出碳酸钙的质量,样品中碳酸钙的质量分数=![]() ,要计算样品中碳酸钙的质量分数,还要预先测定样品A的质量。
,要计算样品中碳酸钙的质量分数,还要预先测定样品A的质量。
(6)若C中石灰水变浑浊,说明有二氧化碳没有被氢氧化钠溶液吸收,会导致计算出的碳酸钙质量偏小,由碳酸钙的质量分数=![]() ,可知会导致测得的样品中CaCO3 的质量分数偏低。
,可知会导致测得的样品中CaCO3 的质量分数偏低。

 口算题天天练系列答案
口算题天天练系列答案【题目】小聪同学家新换了水龙头,从说明书上了解到该水龙头是铜质镀铬.好奇的小聪想探究铬(Cr)与常见金属铁、铜的活动性强弱,请把以下探究过程补充完全.
(作出猜想):1.Cr>Fe>Cu 2. Fe>Cu>Cr 3.________.
(查阅资料)(1)铬是银白色有光泽的金属,在空气中其表面能生成抗腐蚀的致密的氧化膜.
(2)铬能与稀硫酸反应,生成蓝色的硫酸亚铬(CrSO4)溶液.
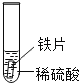
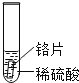
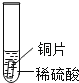
(设计与实验)小聪同学取大小相等的三种金属片,用砂纸打磨光亮;再取三支试管,分别放入等量的同种浓度的稀硫酸.
实验 | 试管1 | 试管2 | 试管3 |
实验操作 |
|
|
|
实验现象 | 铁片表面产生气泡较慢,溶液变为浅绿色 | 铬片表面产生气泡较快,溶液变为蓝色 | 无明显现象 |
(结论与解释)(1)小聪得到的结论是猜想________ 正确.
(2)实验前用砂纸打磨金属片的目的是________.
(知识运用)如果将光洁的铬片投入到CuSO4溶液中,反应的现象为______.反应的化学方程式为_______.