题目内容
为了测定某牛奶样品中蛋白质的含量,现采用“盖尔达法”分解其中的蛋白质。其原理是把蛋白质中的氮元素完全转化成氨气(化学式为NH3),再用稀硫酸吸收氨气,反应的化学方程式:2NH3+H2SO4=(NH4)2SO4
现取该牛奶样品30 mL,用“盖尔达法”分解其中的蛋白质,产生的氨气用9.5 g溶质质量分数为4.9%的稀硫酸恰好完全吸收。计算并回答下列问题:
(1)产生氨气的质量是多少克?(计算结果精确到0.01 g,下同)
(2)30 mL牛奶中含氮元素的质量是多少克?
(3)下图是该牛奶包装标签的部分内容。已知牛奶中的蛋白质含氮元素的质量分数为16%,请你通过计算确定,该牛奶样品中蛋白质的含量是否达到了包装标签所标示的蛋白质的质量标准。
配料:鲜牛奶 保质期:8个月 净含量:250 mL/盒 营养成分:(每100 mL) 钙≥0.11 g 脂肪≥3.30 g 蛋白质≥2.90 g |
【答案】
(1)0.16 g?????? (2)0.13 g
(3)2.70 g<2.90 g,所以该牛奶未达到标签所标示的质量标准。
【解析】由已知的化学方程式,根据硫酸的质量可求出氨气的质量,进而求出氮元素的质量。根据30 mL的含氮量可求出100 mL牛奶中的含氮量,然后与2.90 g作比较,看是否符合质量标准。
(1)设产生氨气的质量为x
2NH3?????? +????? H2SO4=(NH4)2SO4
34??????????? 98
x????????? 9.5 g×4.9%

x=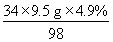 ≈0.16 g
≈0.16 g
(2)0.16 g×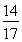 ×100%≈0.13 g。
×100%≈0.13 g。
(3)100 mL牛奶中含蛋白质
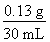 ×100 mL÷16%≈2.70 g<2.90 g
×100 mL÷16%≈2.70 g<2.90 g
所以该牛奶未达到标签所标示的质量标准。

练习册系列答案
 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案
相关题目
 为了测定某牛奶样品中蛋白质的含量,现采用“盖尔达法”分解其中的蛋白质.其原理是把蛋白质中的氮元素完全转化成氨气(化学式为:NH3),再用稀硫酸吸收氨气,反应的化学方程式:
为了测定某牛奶样品中蛋白质的含量,现采用“盖尔达法”分解其中的蛋白质.其原理是把蛋白质中的氮元素完全转化成氨气(化学式为:NH3),再用稀硫酸吸收氨气,反应的化学方程式: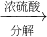 硫酸铵
硫酸铵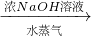 氨,为了测定某牛奶样品中蛋白质的含量,取30mL牛奶用盖尔达法分离蛋白质,把氮元素完全转化成氨(NH3),用50g4.9%稀H2SO4溶液吸收后,剩余的酸需要用38.0g4.0%的NaOH溶液中和,问
氨,为了测定某牛奶样品中蛋白质的含量,取30mL牛奶用盖尔达法分离蛋白质,把氮元素完全转化成氨(NH3),用50g4.9%稀H2SO4溶液吸收后,剩余的酸需要用38.0g4.0%的NaOH溶液中和,问