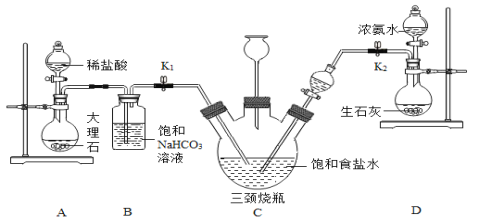
��Ŀ����
����Ŀ��ijʵ��С���ͬѧ������������Һ�������������кͷ�Ӧ��ʵ�飬���ձ��е�����������Һ�μ�һ������ϡ����������ǵμ�ָʾ������ʱ������ֹͣ�μ�ϡ���ᣬ�����ձ�����Һ�����ʵijɷֽ���̽����
��1��д�����кͷ�Ӧ�Ļ�ѧ����ʽ_____��
��2��̽���ձ�����Һ�����ʵijɷ֣�
���������룩
��A�����ʿ�����CaCl2��Ca��OH��2
��B�����ʿ�����CaCl2
��C�����ʿ�����_____
���������ϣ�CaCl2��Һ������
��ʵ����ƣ�
��ȡ�����ձ��е���Һ���Թ��У������Թ��еμӼ�����ɫ��̪��Һ�����۲쵽��̪��Һ����ɫ�������ų��˲��루A��������Ϊ�ų����루A����������_____��
��С������̼������Һ����֤�����ֲ��룬����������ʵ�飬��д���±���
ʵ�鲽�� | Ԥ������ | Ԥ�ƽ��� |
ȡ������Ӧ�����Һ���Թ��У���μ���̼������Һ | _____ | ���루B����ȷ |
_____ | ���루C����ȷ |
��������˼��
Ϊȷ�����루C����ȷ�����м���ʵ�鷽������������_____������ĸ����
A ȡ��Ӧ�����Һ���Թ��У��μ���ɫʯ����Һ���ɫ
B ȡ��Ӧ�����Һ���Թ��У�����п��ð����
C �ýྻ�IJ�����պȡ��Ӧ�����Һ��ͿĨ��pH��ֽ�ϣ�����Һ��pH<7
D ȡ��Ӧ�����Һ���Թ��У�������������Һ�����ɰ�ɫ����
���𰸡�![]() CaCl2��HCl ����������Һ�Լ��ԣ��μӷ�̪��ҺӦ�Ժ�ɫ ������ɫ���� �Ȳ������ݣ��������ɫ���� D
CaCl2��HCl ����������Һ�Լ��ԣ��μӷ�̪��ҺӦ�Ժ�ɫ ������ɫ���� �Ȳ������ݣ��������ɫ���� D
��������
��1������������ϡ���ᷴӦ�����Ȼ��ƺ�ˮ���÷�Ӧ�Ļ�ѧ����ʽΪ��![]() ��
��
��2�� �������룺����������ϡ���ᷴӦ�����Ȼ��ƺ�ˮ�����������ƺ�ϡ����ǡ����ȫ��Ӧ��������Ϊ��CaCl2������������δ��ȫ��Ӧ��������Ϊ��CaCl2��Ca(OH)2�������������������Ϊ��CaCl2��HCl���ʣ�C�����ʿ����ǣ�CaCl2��HCl��
ʵ����ƣ�����ɫ��̪��Һ�����죬���������Լ��ԣ���ʹ��ɫ��̪��Һ��죬��̪��Һ����ɫ��˵�������������ƣ����ų��˲���A���������������Һ�Լ��ԣ��μӷ�̪��ҺӦ�Ժ�ɫ��
�������B������������ֻ���Ȼ��ƣ��Ȼ�����̼���Ʒ�Ӧ����̼��ƺ��Ȼ��ƣ�ʵ������Ϊ��������ɫ������
�����C������������Ϊ�Ȼ��ƺ�HCl��̼��������HCl��Ӧ�����Ȼ��ơ�������̼��ˮ����HCl��ȫ��Ӧ��̼���������Ȼ��Ʒ�Ӧ����̼��ƺ��Ȼ��ƣ���ʵ������Ϊ���Ȳ������ݣ��������ɫ������
������˼��A��ȡ��Ӧ�����Һ���Թ��У��μ���ɫʯ����Һ���ɫ����ɫʯ����Һ�����죬�����������������Һ�в���ɫ���μ���ɫʯ����Һ���ɫ������֤������C���������������⣻
B��п����ϡ���ᷴӦ�����Ȼ�п��������п���������ƺ��Ȼ��ƾ�����Ӧ�������ݲ�����˵������C���������������⣻
C���Ȼ�����Һ�����ԣ����������ԣ���������Ϊ�Ȼ��ƺ�HCl������Һ�����ԣ�pH��7�������pH��7������֤������C���������������⣻
D����������HCl���Ȼ��ƾ��ܲ�����ɫ��������֤������C�������������⡣
��ѡD��

 �±�Сѧ��Ԫ�Բ���ϵ�д�
�±�Сѧ��Ԫ�Բ���ϵ�д� �ִʾ��ƪϵ�д�
�ִʾ��ƪϵ�д�