题目内容
某化学兴趣小组的同学在做“木炭还原氧化铜”实验时,进行如下探究,实验装置如图甲所示(假设木炭粉中不含其它杂质).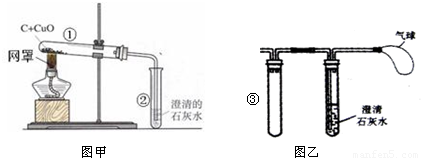
(1)刚开始预热时,试管②中立即产生气泡,但石灰水不变浑浊,原因是______;
(2)继续加热,观察到试管②中澄清石灰水逐渐变浑浊,试管①中黑色粉末中出现红色物质.请你写出其中的一个化学方程式:______ 2Cu+CO2↑(或CO2+Ca(OH)2═CaCO3↓+H2O)
【答案】分析:(1)根据试管中有空气,受热时易膨胀分析;
(2)根据碳能与氧化铜反应生成铜和二氧化碳,二氧化碳能使澄清的石灰水变浑浊,写出反应的方程式;
(3)根据木炭、氧化铜与硫酸的反应分析;
(4)根据一氧化碳是对大气有污染的气体分析,加入试管③可以有效地防止倒吸.
解答:解:(1)由于试管中有空气,受热时易膨胀,所以,开始加热时排出的时是试管中的空气;
(2)在高温时,碳能与氧化铜反应生成铜和二氧化碳,二氧化碳能与氢氧化钙反应生成碳酸钙沉淀和水,反应的方程式是:C+2CuO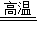 2Cu+CO2↑,CO2+Ca(OH)2═CaCO3↓+H2O;
2Cu+CO2↑,CO2+Ca(OH)2═CaCO3↓+H2O;
(3)由于木炭不能与硫酸的反应、氧化铜与硫酸的反应.所以,为了确定该黑色固体的成分,同学们进行了如下探究活动为:取少量反应后的试管①中的固体于洁净试管内,滴入稀硫酸,微热.若无现象,则该黑色固体是木炭;若黑色粉末溶解,溶液由无色逐渐变为蓝色,则该黑色固体是氧化铜;
(4)由于在高温时,碳能与氧化铜反应中会产生一氧化碳,一氧化碳对大气有污染.所以,图乙中气球的作用是:收集尾气,防止一氧化碳对大气的污染.加入试管③可以有效地防止倒吸,防止试管炸裂.
故答为:(1)开始排出的是试管内的空气,(2)C+2CuO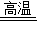 2Cu+CO2↑(或CO2+Ca(OH)2═CaCO3↓+H2O);(3)稀硫酸,黑色粉末溶解,溶液由无色逐渐变为蓝色;(4)收集尾气,防止一氧化碳对大气的污染,防倒吸.
2Cu+CO2↑(或CO2+Ca(OH)2═CaCO3↓+H2O);(3)稀硫酸,黑色粉末溶解,溶液由无色逐渐变为蓝色;(4)收集尾气,防止一氧化碳对大气的污染,防倒吸.
点评:本题是对碳还原氧化铜的实验和实验操作的综合考查,注意类似知识的迁移和灵活运用就能较快解答本题.
(2)根据碳能与氧化铜反应生成铜和二氧化碳,二氧化碳能使澄清的石灰水变浑浊,写出反应的方程式;
(3)根据木炭、氧化铜与硫酸的反应分析;
(4)根据一氧化碳是对大气有污染的气体分析,加入试管③可以有效地防止倒吸.
解答:解:(1)由于试管中有空气,受热时易膨胀,所以,开始加热时排出的时是试管中的空气;
(2)在高温时,碳能与氧化铜反应生成铜和二氧化碳,二氧化碳能与氢氧化钙反应生成碳酸钙沉淀和水,反应的方程式是:C+2CuO
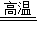 2Cu+CO2↑,CO2+Ca(OH)2═CaCO3↓+H2O;
2Cu+CO2↑,CO2+Ca(OH)2═CaCO3↓+H2O;(3)由于木炭不能与硫酸的反应、氧化铜与硫酸的反应.所以,为了确定该黑色固体的成分,同学们进行了如下探究活动为:取少量反应后的试管①中的固体于洁净试管内,滴入稀硫酸,微热.若无现象,则该黑色固体是木炭;若黑色粉末溶解,溶液由无色逐渐变为蓝色,则该黑色固体是氧化铜;
(4)由于在高温时,碳能与氧化铜反应中会产生一氧化碳,一氧化碳对大气有污染.所以,图乙中气球的作用是:收集尾气,防止一氧化碳对大气的污染.加入试管③可以有效地防止倒吸,防止试管炸裂.
故答为:(1)开始排出的是试管内的空气,(2)C+2CuO
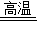 2Cu+CO2↑(或CO2+Ca(OH)2═CaCO3↓+H2O);(3)稀硫酸,黑色粉末溶解,溶液由无色逐渐变为蓝色;(4)收集尾气,防止一氧化碳对大气的污染,防倒吸.
2Cu+CO2↑(或CO2+Ca(OH)2═CaCO3↓+H2O);(3)稀硫酸,黑色粉末溶解,溶液由无色逐渐变为蓝色;(4)收集尾气,防止一氧化碳对大气的污染,防倒吸.点评:本题是对碳还原氧化铜的实验和实验操作的综合考查,注意类似知识的迁移和灵活运用就能较快解答本题.

练习册系列答案
相关题目
 12、碳酸氢钠(NaHCO3)俗称小苏打,常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的性质进行探究.
12、碳酸氢钠(NaHCO3)俗称小苏打,常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的性质进行探究.


 (2012?烟台)某化学兴趣小组的同学用如图所示装置进行实验(装置气密性良好),先关闭止水夹,将足量的氢氧化钠溶液滴入烧瓶中,充分吸收掉二氧化碳后,再打开止水夹.
(2012?烟台)某化学兴趣小组的同学用如图所示装置进行实验(装置气密性良好),先关闭止水夹,将足量的氢氧化钠溶液滴入烧瓶中,充分吸收掉二氧化碳后,再打开止水夹. 某化学兴趣小组的同学在实验室配制质量分数为8%的氢氧化钠溶液,并用其测定某稀盐酸中溶质的质量分数.
某化学兴趣小组的同学在实验室配制质量分数为8%的氢氧化钠溶液,并用其测定某稀盐酸中溶质的质量分数.