题目内容
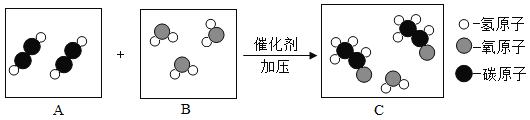
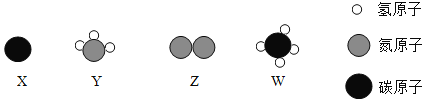
【题目】密闭容器中甲物质在点燃的条件下发生反应,生成物和反应物共四种,它们的微观示意图和反应前后的质量如下表所示,则下列说法不正确的是( )
物质 | 甲 | 乙 | 丙 | 丁 |
|
微观示意图 |
|
|
|
| |
反应前质量/g | 68 | 98 | y | 0 | |
反应后质量/g | x | 2 | 59 | z |
A.上述反应的化学方程式为4NH3+3O2 2N2+6H2O
2N2+6H2O
B.x+z=105
C.反应后氮元素的化合价升高,氧元素的化合价降低
D.(68-x):(59-y)=17:14
【答案】B
【解析】
反应后质量增多的物质是生成物,质量减少的物质是反应物,差量是生成的质量或参加反应的质量。
A、由微观示意图可知,甲是NH3、乙是O2、丙是N2、丁是H2O,因为该反应是甲物质在点燃的条件下发生反应,氧气支持燃烧,故该反应的化学方程式为:4NH3+3O2 2N2+6H2O,此选项正确;
2N2+6H2O,此选项正确;
B、由表中数据可知,参加反应的O2的质量为96g,因此可计算出参加反应的NH3、生成的N2、生成的H2O的质量分别为68g、56g、108g,则x=0、y=3、z=108,所以x+z=108,此选项错误;
C、反应前后氮元素的化合价由-3变为0,氧元素的化合价由0变为-2,故反应后氮元素的化合价升高,氧元素的化合价降低,此选项正确;
D、(68-x):(59-y)=68:56=17:14,此选项正确。
故选B。

【题目】某化学兴趣小组用化学方法测定一种钢样品中铁的含量,同学们称取了6.4g钢样品,投入装有50.0g稀盐酸的烧杯中恰好完全反应(假设样品中的其他物质不与酸反应)在实验过程中对烧杯(包括溶液和残余固体)进行四次称量,记录数据如下表:
反应时间/s | 0 | t1 | t2 | t3 |
烧杯和药品的质量/g | 85.4 | 85.3 | 85.2 | 85.2 |
请计算:
(1)反应生成氢气的质量为_____g。
(2)所用稀盐酸的溶质质量分数_____。