题目内容
【题目】某化学兴趣小组用化学方法测定一种钢样品中铁的含量,同学们称取了6.4g钢样品,投入装有50.0g稀盐酸的烧杯中恰好完全反应(假设样品中的其他物质不与酸反应)在实验过程中对烧杯(包括溶液和残余固体)进行四次称量,记录数据如下表:
反应时间/s | 0 | t1 | t2 | t3 |
烧杯和药品的质量/g | 85.4 | 85.3 | 85.2 | 85.2 |
请计算:
(1)反应生成氢气的质量为_____g。
(2)所用稀盐酸的溶质质量分数_____。
【答案】0.2 14.6%
【解析】
根据质量守恒定律,烧杯内减少的质量即生成氢气的质量,据此根据反应的化学方程式列式计算出参加反应的稀盐酸中溶质的质量,进而计算出所用稀盐酸的溶质质量分数。
(1)根据题意可知,生成氢气的质量为85.4g﹣85.2g=0.2g;
(2)设参加反应的稀盐酸中溶质的质量为x,
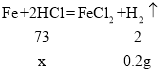
![]()
x=7.3g
所用稀盐酸的溶质质量分数为![]() ×100%=14.6%。
×100%=14.6%。

练习册系列答案
相关题目
【题目】密闭容器中甲物质在点燃的条件下发生反应,生成物和反应物共四种,它们的微观示意图和反应前后的质量如下表所示,则下列说法不正确的是( )
物质 | 甲 | 乙 | 丙 | 丁 |
|
微观示意图 |
|
|
|
| |
反应前质量/g | 68 | 98 | y | 0 | |
反应后质量/g | x | 2 | 59 | z |
A.上述反应的化学方程式为4NH3+3O2 2N2+6H2O
2N2+6H2O
B.x+z=105
C.反应后氮元素的化合价升高,氧元素的化合价降低
D.(68-x):(59-y)=17:14