题目内容
同学们在学习Ca(OH)2的化学性质时,对Ca(OH)2溶液和Na2CO3溶液反应后溶液中溶质的成分进行探究.请你一同探究并回答下列问题:
提出问题:滤液中的溶质是什么物质?
查阅资料:①Ca(NO3)2溶液呈中性.②Ca(NO3)2+Na2CO3=CaCO3↓+2NaNO3
猜想假设:
甲同学认为:只含有NaOH;
乙同学认为:只含有NaOH Ca(OH)2;
丙同学认为:含有NaOH Ca(OH)2Na2CO3;
你认为可能含有 .
分析讨论:丁同学认为 同学的猜想肯定是不合理的,理由是 .
实验设计:请你设计一个简单的实验来验证你的猜想是正确的.
| 实验步骤 | 实验现象 | 实验结论 |
| 取滤液于试管中 | | 猜想正确 |
| 实验步骤 | 实验现象 | 实验结论 |
| 取滤液于试管中滴加少量的稀盐酸 | 无明显现象 | 猜想正确 |
反思拓展:在分析化学反应后所得物质的成分时,除了考虑生成物外,还需要考虑 .
猜想假设:NaOH 和 Na2CO3.
分析讨论:丙;如果氢氧化钙和碳酸钠同时存在时会发生化学反应.
实验设计:滴加足量的硝酸钙溶液,再滴入几滴酚酞试液;出现白色沉淀,酚酞试液变红色.
甲同学的实验结论不正确,因为如果含有NaOH 和 Ca(OH)2时,滴加少量的稀盐酸时也是无明显现象.
不正确;如果含有NaOH 和 Ca(OH)2时,滴加少量的稀盐酸时也是无明显现象.
反思拓展:反应物是否有剩余.
解析试题分析:猜想假设:
氢氧化钙和碳酸钠反应时,可能恰好完全反应,这时的滤液中含有的溶质是氢氧化钠;
如果氢氧化钙过量时,滤液中含有的溶质是氢氧化钠和氢氧化钙;
如果碳酸钠过量时,滤液中含有的溶质是氢氧化钠和碳酸钠.
故填:NaOH 和 Na2CO3.
分析讨论:
丙同学的猜想肯定是不合理的,因为氢氧化钙和碳酸钠不能共存.
故填:丙;如果氢氧化钙和碳酸钠同时存在时会发生化学反应.
实验设计:
实验步骤:取滤液于试管中,滴加足量的硝酸钙溶液,再滴入几滴酚酞试液;
实验现象:出现白色沉淀,酚酞试液变红色.
故填:滴加足量的硝酸钙溶液,再滴入几滴酚酞试液;出现白色沉淀,酚酞试液变红色.
甲同学的实验结论不正确,因为如果含有NaOH 和 Ca(OH)2时,滴加少量的稀盐酸时也是无明显现象.
故填:不正确;如果含有NaOH 和 Ca(OH)2时,滴加少量的稀盐酸时也是无明显现象.
反思拓展:
在分析化学反应后所得物质的成分时,除了考虑生成物外,还需要考虑反应物是否有剩余.
故填:反应物是否有剩余.
考点:实验探究物质的组成成分以及含量.
点评:本题是实验分析题,通过实验现象来判断物质的组成,可见认真观察实验现象是多么重要.

探究(1):碳酸氢钠(NaHCO3)俗名小苏打,常用于食品和医学工业.某化学兴趣小组的同学对碳酸氢钠进行加热,发现有气泡,同时还剩余白色固体.他们对白色固体进行探究.
【提出问题】这白色固体是什么?
【查阅资料】碳酸氢钠受热易分解生成水、二氧化碳和一种常见的固体.
【提出猜想】
猜想1:白色固体是碳酸钠,
猜想2:白色固体是氢氧化钠
猜想3:白色固体是氢氧化钠和碳酸钠的混合物
【实验探究】
兴趣小组为了确定反应后的固体产物成分,进行了如下实验,请填写下表:
| 实验方案 | 实验现象 | 结论 |
| 步骤一:取少量反应后的固体产物溶于水,加入过量的中性氯化钙溶液,过滤. | 产生白色沉淀 | 猜想1成立 |
| 步骤二:取滤液少许,往滤液中滴入:① | ② |
探究2:某化学兴趣小组把金属钠投到硫酸铜溶液中,实验并非如想象的有红色铜析出,而是生成一种蓝色沉淀.同学们非常好奇并进行实验探究.
【提出问题】金属钠投到硫酸铜溶液中到底发生了怎样的化学反应?
【查阅资料】钠是非常活泼的金属,能与水发生剧烈反应,并放出气体,生成的溶液显碱性
【提出猜想】
猜想1:钠先与水反应生成氢气和某碱溶液,某碱再与硫酸铜反应生成蓝色沉淀;
猜想2:钠先与水反应生成某气体和某碱溶液,某碱再与硫酸铜反应生成蓝色沉淀;
【实验探究】
实验一:同学们把一小块切干净的钠投到装有少量蒸馏水的试管中,点燃生成的气体,听到“噗”的一声后燃烧起来;
实验二:在剩余的溶液中加入硫酸铜溶液,发现有蓝色沉淀.
【实验总结】
①两个猜想中的“某碱”是 ,猜想2中生成的气体是 ;
②水与金属钠反应的化学方程式 .
③请你判断猜想 成立.
某化学兴趣小组的同学往氢氧化钠溶液中滴加稀盐酸时,没有看到明显现象.
【提出问题】氢氧化钠与盐酸是否发生了化学反应?
【查阅资料】酸与碱发生中和反应会放出热量.
【实验设计】甲、乙、丙三位同学分别设计了如下实验方案,请你帮他们完成实验报告.
| 同学 | 实验操作 | 现象 | 结论 |
| 甲 |  | 溶液由红色变成 | 氢氧化钠与盐酸发生了化学反应,反应的化学方程式为 |
| 乙 | 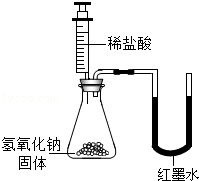 | U型玻璃管中 边的红墨水液面下降(所加稀盐酸的体积忽略不计) | 氢氧化钠与盐酸发生了化学反应 |
| 丙 | 用 测定氢氧化钠溶液的pH,向其中滴加足量稀盐酸,再测定溶液的pH | 最后溶液的pH (填“≥7”、“≤7”、“不变” | 氢氧化钠与盐酸发生了化学反应 |
【评价反思】你认为实验设计方案不合理的同学是 ,理由是 .
【拓展延伸】另有一位同学向自己配制的氢氧化钠溶液中滴加酚酞试液时,溶液变红色,可是红色即可消失了,出现此意外情况的原因是 (填以下序号).
A.所用的酚酞试液是变质的
B.所用的氢氧化钠溶液浓度太小
C.氢氧化钠溶液吸收了空气中二氧化碳
2013年中央电视台举办的“3.15”晚会,曝出某品牌金饰品掺假的事件,引起同学们的好奇。某化学兴趣小组在老师的帮助下,对几种常见金属饰品所含的金属进行了相关的探究活动。
【提出问题】
(1)怎样鉴别真假黄金?
(2)怎样确定钯的金属活动性?
【查阅资料】
(1)假黄金通常是黄铜(Cu-Zn合金);
(2)钯(Pd)呈银白色,有金属光泽,可用作饰品。
【实验药品】
钯、铂(Pt)、稀盐酸、硝酸银溶液和氯化钯(PdCl2)溶液
【实验探究】
(1)鉴别黄金样品的真假
取黄金样品于试管中,滴加稀盐酸后,观察到黄金样品表面有气泡产生,该气体是 ,说明此样品为 .(选填“真”或“假”)黄金。
(2)探究钯的金属活动性
依据生活经验,同学们猜想钯的活动性可能与银和铂相近,于是他们利用上述药品进行如下实验:
| 实验步骤 | 实验现象 | 实验结论 |
| 把钯浸入硝酸银溶液中 | . | 钯的活动性比银弱 |
| 把铂浸入氯化钯溶液中 | 无明显现象 | 钯的活动性比铂 . |
初步得出结论:钯、银、铂的金属活动性由强到弱的顺序为 。
【废液处理】
(1)转化成沉淀。小组同学将所有液体倒入废液缸中,出现白色沉淀。写出产生该现象的化学方程式 .(写出一个即可);
(2)通过科学合理的方法进一步回收金属钯。
小丽实验操作模拟考试的考题是:用碳酸钠溶液鉴别稀盐酸、食盐水和澄清石灰水。
【进行实验】
| 操作步骤 | 实验现象 | 实验结论 |
| 分别用A、B、C三支试管取样,然后各加入适量碳酸钠溶液 | A中无明显现象 B中 C中 | A中的物质是食盐水 B中的物质是稀盐酸,发生反应的方程式 C中的物质是澄清石灰水 |
【发现问题】如何处理上述废液才能减少对环境的污染?
【思考与分析】应先对废液中的溶质成分进行探究,后制定方案。
【实验与探究】
⑴小丽将所有废液倒入一洁净烧杯中,静置后得到上层清液;
⑵取少量清液加入足量的氯化钙溶液(中性),再滴加几滴无色酚酞试液,若出现 的现象,说明上层清液中一定有碳酸钠和氢氧化钠,一定没有 (填离子符号)。
【方法与应用】通过以上探究,处理上述废液的正确方法是 以减少对环境的污染。
哈尔滨西客站是我国高寒地区最大的客运综合交通枢纽,车站分上下五层,由l8座站台、22条铁路到发线、高架候车室,以及公交枢纽站、地铁车站、出租车站等组成。下列叙述错误的是( )
| A.西客站的建成,缓解了哈尔滨火车站的压力 |
| B.西客站建设时用N-Y"大量的钢材,钢材属于复合材料 |
| C.目前,连接西客站的市内公交系统也日益完善 |
| D.西客站可以满足旅客无缝隙转乘车 |

