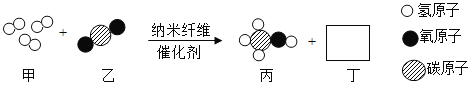
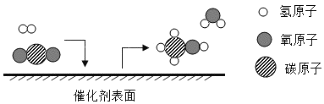
题目内容
【题目】金属及金属材料在生产生活中应用广泛。
(1)下列金属制品中,利用金属导热性的是____________(填字母)。

(2)不能用铁质容器盛放波尔多液(主要成分是硫酸铜和氢氧化钙),用化学方程式表示其原因_______________________________。
(3)防止金属锈蚀是保护金属资源的有效途径之一。洁净的铁钉在下列条件下容易生锈的是________________(填字母)
A 在干燥的空气中 B 在潮湿的空气中
C 浸没在植物油中 D 部分浸入食盐水中
【答案】C Fe+CuSO4=FeSO4+Cu BD
【解析】
(1)铜制火锅是利用金属导热性;
(2)波尔多液是一种农业上常用的杀菌剂,它由硫酸铜、生石灰加水配制而成,不能用铁质容器配制波尔多液的原因是铁比铜活泼,能将铜从其溶液中置换出来,反应的化学方程式是:Fe+CuSO4=FeSO4+Cu:
(3)铁生锈的条件是能与水、氧气接触,洁净的铁钉在潮湿的空气中容易生锈;
A.在干燥的空气中缺少水蒸气,铁钉不容易生锈;
B.在潮湿的空气中,铁钉和氧气、水蒸气充分接触,容易生锈;
C.浸没在植物油中时,铁钉不能和氧气、水蒸气接触,不容易生锈;
D.部分浸入食盐水中,铁钉和氧气、水蒸气充分接触,容易生锈; 故选:BD。
故答为:(1)C;(2)Fe+CuSO4=FeSO4+Cu;(3)BD。

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案【题目】化学学习小组进行“铝和酸溶液反应的探究”的活动。用铝片分别和氢离子浓度相同的稀盐酸、稀硫酸反应,发现铝片和稀盐酸反应现象非常明显,而和稀硫酸却几乎不反应。
(提出问题)是什么原因导致两者的差异?
两种酸中氢离子浓度相同,那么存在的差异就可能跟H+所处的环境不同有关(如阴离子的不同)。
(作出猜想)猜想一:Cl-能促进金属铝与H+的反应。
猜想二:_____。
猜想三:铝表面的致密氧化膜有保护作用,使H+与铝不易接触。
为了验证上述假设,经充分讨论,大家设计了如下实验方案进行验证。
(查阅资料)已知 9.8%H2SO4 溶液和 7.3%HCl 溶液中 H+浓度相同。
(设计实验)
① | 9.8%H2SO4溶液5mL+铝片 | 不加其他试剂(对比) | 无气泡 |
② | 9.8%H2SO4溶液5mL+铝片 | 加入_____溶液 | 有较多气泡 |
③ | 9.8%H2SO4溶液5mL+铝片 | 加入 0.5mL Na2SO4 溶液 | 无气泡 |
④ | 7.3%HCl 溶液 5mL+铝片 | 加入_____溶液 | 有较多气泡 |
⑤ | 7.3%HCl 溶液 5mL+铝片 | 不加其他试剂(对比) | 有较多气泡 |
由实验②③得出猜想_____成立;由④⑤得出猜想_____不成立。为了验证猜想一成立,小明认为只需要在 5mL 9.8%H2SO4 溶液和铝片中加入_____,并与实验①对比即可。
(实验拓展)对于有气体生成的化学反应,我们可以用产生气体的速率来比较反应速率。为准确比较,应该测量收集相同体积气体所需的_____,因此,上述收集氢气应该采用_____法。
为了真实地观察未打磨的铝片与稀盐酸反应的情况,小红用压强传感器测量集气瓶中气体压强的变化,如图所示。
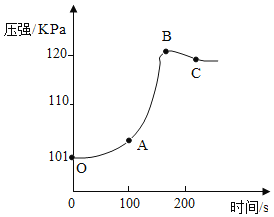
请解释曲线变化的原因:
OA 段_____;AB 段_____;BC 段_____。指出反应结束并恢复到常温时集气瓶内的压强值约为_____kpa。