题目内容
【题目】氯化钙在生活中常用作干燥剂、融雪剂,在工业上可用于制造防冻液等。某工厂以石灰石(原料石灰石中含的杂质是MgSO4和Al2O3为原料生产氯化钙晶体的流程如图(所加试剂均完全反应)。
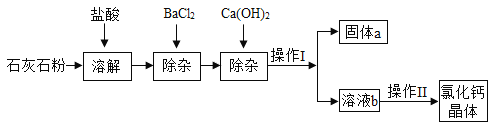
(1)石灰石粉加适量盐酸溶解时,Al2O3发生反应的化学方程式为_____。
(2)加入适量的Ca(OH)2溶液是为了除去_____(填离子符号)。
(3)加入适量的BaCl2溶液发生反应的化学方程式为_____。
(4)操作Ⅰ、操作Ⅱ中玻璃棒的作用_____(选填“相同”或“不同”)。
【答案】Al2O3+6HCl=2AlCl3+3H2O Mg2+、Al3+ MgSO4+BaCl2=BaSO4↓+MgCl2 不同
【解析】
(1)氧化铝与盐酸反应生成氯化铝和水,化学方程式为Al2O3+6HCl=2AlCl3+3H2O。
(2)铝离子与氢氧根离子可以生成氢氧化铝,镁离子与氢氧根离子可以生成氢氧化镁,两者都不溶于水,故除去Mg2+、Al3+
(3)氯化钡与硫酸镁反应生成氯化镁和硫酸钡沉淀,化学方程式为MgSO4+BaCl2=BaSO4↓+MgCl2。
(4)操作Ⅰ为过滤,玻璃棒主要是引流,操作Ⅱ为蒸发结晶,玻璃棒主要是搅拌,所以玻璃棒的作用不同。

练习册系列答案
相关题目