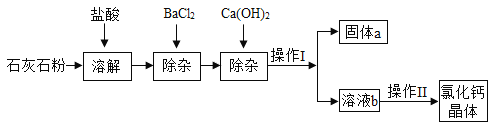
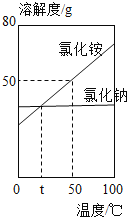
题目内容
【题目】某小组同学拿出一瓶放置较长时间的碳酸铵晶体[(NH4)2CO3H2O],发现固体明显减少,打开瓶盖,闻到一股刺激性气味。同学们对此产生了兴趣,取样品进行实验。
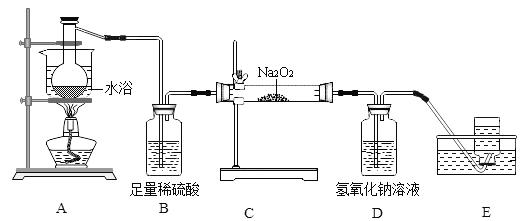
(查阅资料)①(NH4)2CO3H2O ═2NH3↑+ CO2↑+ 2H2O
②过氧化钠(Na2O2)是一种淡黄色固体,能与CO2、H2O、NH3等物质反应:相关化学方程式为:2Na2O2+2CO2=2Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑
请回答:
(1)装置A水浴的优点是______,当E中观察到______现象时开始收集气体。
(2)碳酸铵晶体应______保存,装置B的作用是______。小组同学又对反应后装置C中固体的成分产生兴趣,同学们取适量固体于试管中,加入足量的蒸馏水溶解形成溶液M,无气泡产生,则该固体中不含_____,该小组同学继续进行探究。
(提出问题)反应后硬质玻璃管中固体的成分是什么?
(做出猜想)猜想一:Na2CO3 猜想二:NaOH 猜想三:______
(实验验证)
(实验结论)猜想三成立。
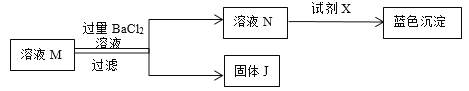
(3)加入过量BaCl2溶液的目的是______、______。
(4)加入试剂X发生的反应方程式为______(写一种)。
(5)溶液N所含阳离子为______(填化学符号)。
【答案】便于控制温度(或受热均匀) 气泡均匀连续放出 密封、低温(答1点即可) 除尽NH3(除去NH3、吸收NH3) Na2O2 Na2CO3、NaOH 检验Na2CO3 除尽Na2CO3(使Na2CO3完全反应) ![]() Na+、Ba2+
Na+、Ba2+
【解析】
放置较长时间的碳酸铵晶体[(NH4)2CO3H2O],发现固体明显减少,打开瓶盖,闻到一股刺激性气味,说明碳酸铵晶体需要密封保存,稀硫酸和氨气反应生成硫酸铵,碳酸钠和氯化钡反应生成碳酸钡和氯化钠,氯化铜和氢氧化钠生成氢氧化铜和氯化钠。
(1)水浴加热便于控制温度,故装置A水浴的优点是便于控制温度(或受热均匀),当E中观察到气泡均匀连续放出现象时开始收集气体。
(2)放置较长时间的碳酸铵晶体[(NH4)2CO3H2O],发现固体明显减少,打开瓶盖,闻到一股刺激性气味,碳酸铵晶体受热会分解,故碳酸铵晶体应密封、低温保存,稀硫酸和氨气反应生成硫酸铵,故装置B的作用是除尽NH3(除去NH3、吸收NH3)。过氧化钠和水反应生成氢氧化钠和氧气,取适量反应后装置C固体于试管中,加入足量的蒸馏水溶解形成溶液M,无气泡产生,则该固体中不含Na2O2。
[做出猜想]猜想一:Na2CO3 猜想二:NaOH 猜想三:Na2CO3、NaOH
(3)碳酸钠和氯化钡反应生成碳酸钡和氯化钠,故加入过量BaCl2溶液的目的是检验Na2CO3,除尽Na2CO3(使Na2CO3完全反应)。
(4)加入试剂X发生的反应是氯化铜和氢氧化钠生成氢氧化铜和氯化钠,反应的化学方程式为![]() 。
。
(5)碳酸钠和氯化钡反应生成碳酸钡和氯化钠,溶液N所含溶质为生成的氯化钠,过量的氯化钡,故阳离子为钠离子和钡离子,离子符号为Na+、Ba2+。