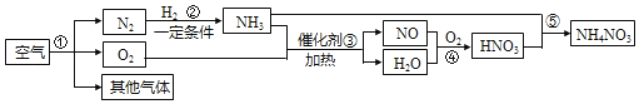
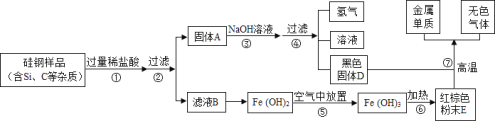
题目内容
【题目】小明同学分析由氯化钙和氯化钠组成的产品中氯化钠的含量。现取13.4g固体,全部溶于96.6g水中,向所得的混合物溶液中滴加溶质质量分数为10.6%的碳酸钠溶液,记录了如图所示的曲线关系。请计算: (写计算过程)
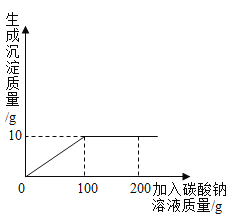
(1)当氯化钙与碳酸钠恰好完全反应时,消耗10.6%的碳酸钠溶液的质量是多少_______?
(2)样品中氯化钠的质量是多少_______?
(3)当氯化钙与碳酸钠恰好完全反应时,过滤,所得溶液中溶质质量分数是多少_______?
【答案】100g 2.3g 7%-
【解析】
(1)由生成沉淀的质量曲线,加入100g碳酸钠溶液时,氯化钙与碳酸钠恰好完全反应;
(2)由恰好完全反应时生成沉淀的质量,根据反应的化学方程式,计算样品中氯化钙的质量,样品质量与氯化钙质量差即样品中氯化钠的质量;
(3)当氯化钙与碳酸钠恰好完全反应时,过滤,所得溶液为氯化钠溶液,其中溶质氯化钠质量为样品中氯化钠与反应生成氯化钠的质量和,利用质量守恒定律,求得反应后溶液的质量,利用溶液中溶质的质量分数计算公式计算所得溶液中溶质的质量分数。
解:(1)由生成沉淀的质量曲线,当氯化钙与碳酸钠恰好完全反应时,消耗10.6%的碳酸钠溶液的质量为100g,生成碳酸钙的质量为10g;
(2)设样品中氯化钙的质量为x,生成氯化钠的质量为y,
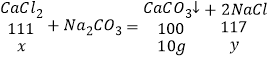
![]() x=11.1g,
x=11.1g,
![]() y=11.7g,
y=11.7g,
所以样品中氯化钠的质量=13.4g-11.1g=2.3g,
(3)所得溶液中溶质质量分数为:![]() ×100%=7%;
×100%=7%;
答:(2)样品中氯化钠的质量是2.3g;
(3)所得溶液中溶质的质量分数是7%。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】化学兴趣小组探究金属的性质时,将一段去除氧化膜的镁条,放入一定量的稀盐酸中,有气泡产生,充分反应后静置,发现试管中有灰白色沉淀。写出产生气泡的反应化学方程式______。
(提出问题)灰白色沉淀是什么物质?
(猜想假设)①小华认为灰白色沉淀为碳酸镁(MgCO3),其他同学认为不需要实验就能否定小华的猜想,理由是_____________________。
②小宇认为由于反应后氯化镁的生成量偏多,灰白色沉淀为不能再溶解的氯化镁固体。
③小彤认为灰白色沉淀为__________________。
(实验探究1)
实验操作 | 现象 | 结论 |
①取试管中的上层清液,加入适量的氯化镁固体 | 氯化镁固体__(选填“溶解”或“不溶解”) | 小宇猜想错误 |
②取适量白色沉淀加入足量稀盐酸中 | 没有气泡冒出 | 小彤猜想错误 |
基于以上探究与分析,原有猜想均遭到了否定。
(查阅资料)
HCl+AgNO3═HNO3+AgCl↓,AgCl是一种白色沉淀。氯化氢是酸性气体,能使蓝色石蕊试纸变红。进行
(实验探究2)
他们又另取灰白色沉淀放入试管中加热,将蘸有硝酸银溶液的玻璃棒伸入试管内,玻璃棒上的溶液出现白色浑浊,证明产生了__气体。如何检验这种气体_______(实验步骤、现象、结论)。
同学们请教老师后得知,足量的镁与稀盐酸反应时,溶液会经历从酸性到碱性且碱性逐步增强的过程,从而生成了碱式氯化镁沉淀。据文献介绍,碱式氯化镁存在多种组成结构,化学通式可表示为Mgx(OH)yClzmH2O(其中2x﹣y﹣z=0,0≤m≤6)。
(反思拓展)
(1)做镁与稀盐酸反应的实验时,为了不让试管中出现灰白色沉淀,镁条的用量_______。
(2)铁片和铜片放入稀硫酸中产生的现象也不相同,据此推测出铁的活动性比铜_____。
【题目】材料在交通工具上有着广泛的应用,根据下列信息回答问题。
应用 |
|
|
共享汽车 |
用到的材料 | 轮胎:橡胶 | 机翼:铝锂合金 | 车身:钢 |
(1)上述交通工具用到的材料属于金属材料的是______(填一种即可),属于有机合成材料的是______。
(2)大飞机C919大量使用合金材料,原因是______。汽车车身表面的烤漆不仅美观,还能起到防锈的作用,工业上常用稀盐酸来除铁锈(Fe2O3),该反应的化学方程式是______。
(3)化石燃料的大量使用,带来了环境的污染和资源的枯竭等问题,共享汽车在广泛推广使用乙醇汽油,其好处是______。
【题目】如图所示,烧瓶内盛有x气体,若挤压滴管的胶头a,使液体y进入烧瓶中,振荡烧瓶,并倒放在铁架台上,将导管伸入滴有z的水中,打开弹簧夹b,可见烧杯中的液体如喷泉一样喷入烧瓶中,并出现颜色的改变.则x、y、z可能是( )
选项 | |||
A | O2 | H2SO4 | 紫色石蕊试液 |
B | CO2 | H2O | 无色酚酞试液 |
C | CO | Ca(OH)2 | 紫色石蕊试液 |
D | CO2 | NaOH | 无色酚酞试液 |
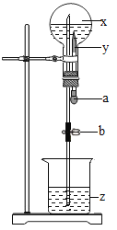
A.A B.B C.C D.D