题目内容
某小组在探究铁、铜、镁、银的金属活动性顺序时,做了如下三个实验(所用金属的形状与大小和稀盐酸的用量均相同):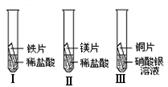
①通过实验Ⅰ和Ⅱ可比较出镁和铁的金属活动性强弱。你认为他们依据的实验现象是 。写出实验Ⅰ中反应的化学方程式: 。
②通过观察到实验Ⅲ的现象可得出的结论是 。
③上述三个实验不能够得出四种金属的活动性顺序。探究小组在上述实验的基础上,补充了一个实验(如图所示),实现了探究目的。他们的实验:金属X、Y溶液分别是 。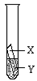
①实验Ⅱ比实验Ⅰ反应剧烈 Fe+2HCl →FeCl2+H2↑
②铜比银活泼
③Fe CuSO4(或Cu H2SO4)
解析试题分析:①比较金属的活动性顺序,可利用以下2个原理:1、金属与酸反应,根据是否会反应或反应的激烈程度,2、金属也盐溶液反应,看是否会反应;所以通过实验Ⅰ和Ⅱ可比较出镁和铁的金属活动性强弱。他们依据的实验现象是:实验Ⅱ比实验Ⅰ反应剧烈,实验Ⅰ中反应的化学方程式:Fe+2HCl →FeCl2+H2↑
②把铜加入到硝酸银溶液中,现象是铜表面析出一层银白色的物质,溶液由无色变为蓝色,得出的结论是:铜比银活泼
③通过实验Ⅰ和Ⅱ,可得出镁的金属活动性>铁,根据实验Ⅲ,可得出铜的金属活动性>银,所以要得出四种金属的活动性顺序,只需比较铁和铜的活动性即可,故金属X、Y溶液分别是:Fe CuSO4(或Cu H2SO4)
考点:金属的化学性质

(6分) 2011年9月29日21时“天宫一号”目标飞行器在酒泉卫星发射中心发射,它是中国首个空间实验室,将分别与神舟八号、神舟九号、神舟十号飞船对接,从而建立第一个中国空间实验室。其结构主要包括外部壳体、实验舱、资源舱、燃料燃烧系统、对接机构和太阳能电板等,制作材料有铝、耐高温的石墨瓦、不锈钢、钛、镍和铜等等。试回答下列问题:
(1)不锈钢属于______________________(填“纯净物”、“混合物”)。
(2)单质铜的金属活动性________ 单质铝的金属活动性(填“大于”、“ 小于”、“等于”);请设计简单实验验证(用化学方程式表示)___________________
|
你注意过吗?家庭使用的铁制工具,隔一段时间不用就变得锈迹斑斑,而街心广场矗立的不锈钢雕塑,几经风霜雨雪总能保持原有的本色。锰(Mn)就是不锈钢的主要添加元素之一,它可以提高不锈钢的耐腐蚀性。
(1)铁与空气中的水和________直接接触会导致铁制品的锈蚀。
(2)不锈钢属于________(填序号)。
| A.纯净物 | B.金属材料 | C.合成材料 | D.复合材料 |
①根据以上实验判断,三种金属的活动性由强到弱的顺序是____________________________________。
②写出锰单质(Mn)与氯化铜溶液发生反应的化学方程式(锰在该反应的化合物中显+2价)________。
我国第四套人民币硬币从1999年开始发行,一元币为钢芯镀镍(Ni),伍角币为钢芯镀铜合金,一角币为铝合金或不锈钢。
(1)铸造以上硬币用到的材料都是 (填“合成材料”或“金属材料”)。
(2)选择铸造硬币的材料不需要考虑的因素是 (填序号)。
| A.金属的导电性 | B.金属的耐腐蚀性 |
| C.金属的硬度 | D.金属价格与硬币面值的吻合度 |