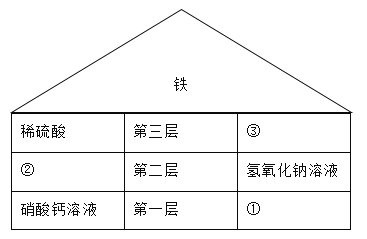
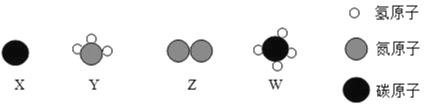
题目内容
【题目】向NaOH溶液中滴入稀H2SO4至恰好完全反应。
(1)写出反应的化学方程式:_______________。
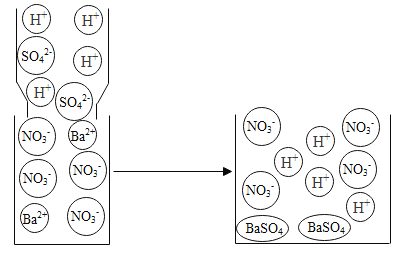
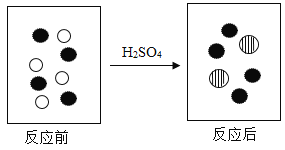
(2)如图小球分别表示NaOH溶液与稀H2SO4反应前后溶液中溶质的粒子。写出下列小球代表的粒子符号:![]() ____________;
____________;![]() _____________。
_____________。
【答案】2NaOH+H2SO4=Na2SO4+ 2H2O Na+ SO42-
【解析】
(1)氢氧化钠溶液和稀硫酸反应生成硫酸钠和水,其反应方程式为:2NaOH+H2SO4=Na2SO4+2H2O。故答案为:2NaOH+H2SO4=Na2SO4+2H2O;
(2)氢氧化钠溶液在水溶液中电离出钠离子和氢氧根离子。稀硫酸在水溶液中能电离出氢离子和硫酸根离子。该反应的微观实质是:酸中的氢离子和碱中的氢氧根离子结合形成水分子。反应前后保持不变的是氢氧化钠溶液中的钠离子和稀硫酸中的硫酸根离子。该反应是将稀硫酸滴入氢氧化钠溶液中,则![]() 表示钠离子,
表示钠离子,![]() 表示硫酸根离子。故答案为:Na+、SO42-。
表示硫酸根离子。故答案为:Na+、SO42-。

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案
相关题目