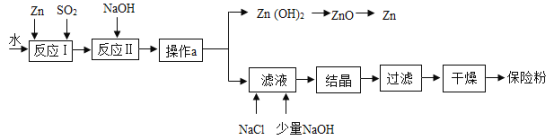
题目内容
【题目】铁是生产、生活中应用广泛的金属材料。
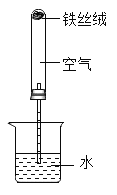
(1)如图所示,某学生分别将浸过食醋的钢丝绒、浸过水的钢丝绒和干燥的钢丝绒放入大小相同的试管A、B、C中,测得玻璃管中水上升的高度。实验结果记录如下。试回答下列问题:
时间/h | 0 | 0.5 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 |
A上升高度/cm | 0 | 0.4 | 3.3 | 5.6 | 6.8 | 9.8 | 13.5 |
B上升高度/cm | 0 | 0 | 0 | 0 | 0 | 0.5 | 1.0 |
C上升高度/cm | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
①本实验中,可能影响铁生锈的因素有:a 试管大小,b 烧杯中的水,c 钢丝绒浸过的液体,d 实验时间。其中能确定影响铁生锈的因素是:__(填写字母)。
②日常生产生活中可以用稀硫酸来除铁锈,请写出该反应的化学方程式_,其反应类型为__反应。
③如果使用较细的玻璃管,则A试管内水面上升的高度将__(选填“增加”或“减小”)。
④A试管内水面上升的原因是_,长期搁置,C试管水面__上升(选填“会”或“不会”)。
⑤A、B、C三支试管内,钢丝绒生锈的速率由大到小的顺序为___。
(2)对铁“发蓝”处理,其表面将形成致密氧化膜而有效避免腐蚀。
①致密氧化膜能有效阻止铁锈蚀的原因是_____。
②“发蓝”过程的化学方程式如下,式中X的化学式为_。
36Fe+4NaNO2+9NaNO3+26H2O=12X+13NaOH+13NH3↑
③为检验“发蓝” 处理的铁质零件表面是否形成致密氧化膜,将该零件浸泡于硫酸铜溶液中,发现零件表面出现红色物质。由此可知该零件“发蓝”处理效果__(填“好” 或“不好”),因为__(用化学方程式表示)。
【答案】bcd Fe2O3+3H2SO4═Fe2(SO4)3+3H2O 复分解 增加 生锈消耗了氧气,管内气体气压变小,大气压将烧杯中的水压上去 会 A>B>C 使铁与氧气(或空气)、水隔绝 Fe3O4 不好 Fe+CuSO4=Cu+FeSO4
【解析】
(1)①根据题干提供的信息结合表格提供的数据可以看出,A、B随着时间的推移,液面上升的越来越高,则时间能影响铁生锈,干燥的钢丝不生锈,则水是影响铁生锈的因素,浸过食醋的钢丝绒液面最先上升,则钢丝浸过的液体影响铁的生锈,故填:bcd;
②铁锈的主要成分是氧化铁,氧化铁与硫酸反应生成硫酸铁和水,反应的方程式为:Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;该反应是两种化合物交换成分生成另外两种化合物,属于复分解反应。故填:Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;复分解;
③铁生锈消耗氧气的体积是一定的,如果换成较细的玻璃管,试管的横截面减小,则A试管内水面上升的高度将增加,故填:增加;
④铁生锈消耗氧气会使密闭容器内的压强减小,在大气压的作用下,烧杯中的水会上升;长时间放置,由于分子的运动,烧杯中的水分子会运动到试管中,从而使钢丝生锈,故填:生锈消耗了氧气,管内气体气压变小,大气压将烧杯中的水压上去;会;
⑤由表格提供的数据可以看出,A中的钢丝最先生锈,然后是B,C中的钢丝没有生锈,故填:A>B>C;
(2)①致密氧化膜能使铁与氧气(或空气)、水隔绝从而有效阻止铁锈蚀;故填:使铁与氧气(或空气)、水隔绝;
②根据质量守恒定律,反应前后原子的种类和数目都没有发生变化,所以生成物中少36个铁原子和48个氧原子,由于X前面的数字是12,所以每个X分子中含有3个铁原子和4个氧原子,故X化学式为:Fe3O4;故填:Fe3O4;
③将该零件浸泡于硫酸铜溶液中,发现零件表面出现红色物质,说明还有露出的铁,说明该零件“发蓝”处理效果不好;露出的铁和硫酸铜溶液反应生成硫酸亚铁和铜,其反应的化学方程式为:Fe+CuSO4=Cu+FeSO4;故填:不好;Fe+CuSO4=Cu+FeSO4。

 名校课堂系列答案
名校课堂系列答案