题目内容
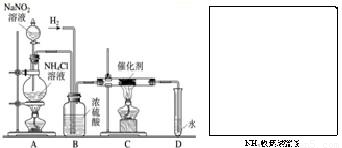
 实验室常用亚硝酸钠(NaNO2)与氯化铵溶液(NH4Cl)反应制取N2.N2的化学性质十分稳定,但在一定条件下能与H2部分化合生成NH3.下图为制取少量NH3并检验NH3的装置(制取H2的装置已略去):
实验室常用亚硝酸钠(NaNO2)与氯化铵溶液(NH4Cl)反应制取N2.N2的化学性质十分稳定,但在一定条件下能与H2部分化合生成NH3.下图为制取少量NH3并检验NH3的装置(制取H2的装置已略去):(1)NaNO2是一种工业用盐,它
不能
不能
(填“能”或“不能”)当作食盐使用.A装置中添加NaNO2溶液的仪器名称是分液漏斗
分液漏斗
.(2)C装置的硬质试管中发生反应的化学方程式为
N2+3H2
2NH3
| ||
| △ |
N2+3H2
2NH3
,反应中N2和H2的最佳质量比是
| ||
| △ |
14:3
14:3
,按此比例进行反应,D中导管口会
会
(填“会”或“不会”)逸出气泡(已知NH3极易溶于水,密度小于空气).请设计能说明有NH3生成的实验向D中滴入无色酚酞溶液,酚酞变红
向D中滴入无色酚酞溶液,酚酞变红
.(3)为收集少量氨气,请在右框中,画出收集NH3的装置图.
(4)B中浓硫酸的作用是
干燥氮气
干燥氮气
、干燥氢气
干燥氢气
(填2种即可)(5)实验中,N2的平均流量为1.4m g/s,H2的流量为0.3m g/s,N2和H2在反应中只能转化40%.
①请计算生成NH3的平均流量.
②若用Zn和稀硫酸反应提供H2,制取1.36mg NH3,计算至少需要金属Zn的质量.
分析:(1)根据亚硝酸钠的毒性进行分析,了解常用仪器的名称和用途;
(2)根据题意可知:氮气与氢气在C处发生反应生成氨气,写出反应方程式;反应中N2和H2的最佳质量比就是方程适中二者的质量比;根据实际的反映情况分析D中导管口有气泡生成,根据氨气的性质进行验证;
(3)根据氨气收集方法确定收集装置;
(4)根据浓硫酸的吸水性分析;
(5))①根据反应的质量比及转化率计算;
②根据锌与稀硫酸反应、氮气与氢气的反应,由氨气的质量求出锌的质量.
(2)根据题意可知:氮气与氢气在C处发生反应生成氨气,写出反应方程式;反应中N2和H2的最佳质量比就是方程适中二者的质量比;根据实际的反映情况分析D中导管口有气泡生成,根据氨气的性质进行验证;
(3)根据氨气收集方法确定收集装置;
(4)根据浓硫酸的吸水性分析;
(5))①根据反应的质量比及转化率计算;
②根据锌与稀硫酸反应、氮气与氢气的反应,由氨气的质量求出锌的质量.
解答:解:(1)由于亚硝酸钠有毒,它不能当作食盐使用.A装置中添加NaNO2溶液的仪器是分液漏斗;
(2)氮气与氢气在C处发生反应生成氨气,反应的方程式是:N2+3H2
2NH3.化学方程式的物质的质量比两物质的最佳质量比,为:14:3;由于是“部分化合”,仍会有未反应的H2和N2逸出.所以,D中导管口会逸出出气泡;由于氨气的水溶液显碱性.所以,验证有NH3生成的实验是:向D中滴入无色酚酞溶液,酚酞变红;
(3)由氨气极易溶于水、密度比空气小,应用向下排空气法收集,装置如图:
(4)由于浓硫酸具有吸水性,可用来干燥氨气和氢气;
(5)①由N2+3H2
2NH3的各物质的质量比为28:6:34=14:3:17,N2的平均流量为1.4m g/s,H2的流量为0.3m g/s,N2和H2在反应中只能转化40%可知,生成NH3的平均流量为:1.7m g/s×40%=0.68m g/s;
②设至少需要金属Zn的质量为X
由制取氨气反应:Zn+H2SO4=ZnSO4+H2↑、N2+3H2
2NH3,得出锌与氨气的关系式为:
3Zn~2NH3
195 34
X 1.36mg
=
解得:X=7.8mg
故答为:(1)不能,分液漏斗;(2)N2+3H2
2NH3,14:3,会,向D中滴入无色酚酞溶液,酚酞变红;(3)见上图;(4)干燥氮气,干燥氢气;(5)①0.68m g/s; ②7.8mg.
(2)氮气与氢气在C处发生反应生成氨气,反应的方程式是:N2+3H2
| ||
| △ |
(3)由氨气极易溶于水、密度比空气小,应用向下排空气法收集,装置如图:

(4)由于浓硫酸具有吸水性,可用来干燥氨气和氢气;
(5)①由N2+3H2
| ||
| △ |
②设至少需要金属Zn的质量为X
由制取氨气反应:Zn+H2SO4=ZnSO4+H2↑、N2+3H2
| ||
| △ |
3Zn~2NH3
195 34
X 1.36mg
| 195 |
| 34 |
| X |
| 1.36mg |
故答为:(1)不能,分液漏斗;(2)N2+3H2
| ||
| △ |
点评:本题考查氨气的实验室制法、氨气的检验、浓硫酸的性质等内容,利用所学知识对知识进行迁移即可解决问题.

练习册系列答案
相关题目
空气的主要成分是氮气和氧气,其中氮气体积约占空气体积的4/5.
(1)请试用这样的推理方法:“如果氧气有颜色,那么空气就会有颜色;而空气是无色的,所以推测氧气是无色的.”结合你的生活经验,对氮气物理性质进行推测,填写下表:
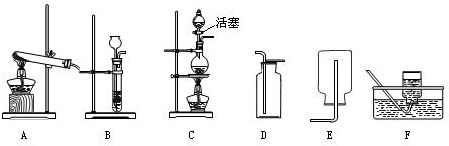
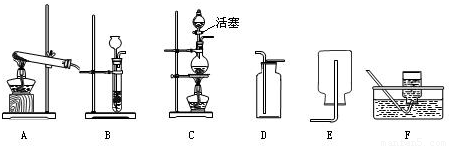
(2)实验室可用亚硝酸钠(NaNO2)固体和氯化铵(NH4Cl)溶液混和加热来制取氮气.现提供如下实验装置,则实验室制取氮气应采用的发生装置是 ,收集装置是 .(填字母)
(3)工业上常用氮气与氢气在高温、高压及催化剂条件下合成氨气,化学反应方程式为 .
N2+3H2
2NH3.现欲制取氨气1.7吨,理论上需要在0℃和标准大气压下的氮气多少升?(已知O℃和标准大气压下氮气的密度为1.25克/升;假设氮气完全转化为氨气)
(1)请试用这样的推理方法:“如果氧气有颜色,那么空气就会有颜色;而空气是无色的,所以推测氧气是无色的.”结合你的生活经验,对氮气物理性质进行推测,填写下表:
| 颜 色 | 气 味 | 水 溶 性 | |
| 氮 气 |

(3)工业上常用氮气与氢气在高温、高压及催化剂条件下合成氨气,化学反应方程式为
N2+3H2
| ||
| 高温高压 |
(2004?绍兴)空气的主要成分是氮气和氧气,其中氮气体积约占空气体积的4/5.
(1)请试用这样的推理方法:“如果氧气有颜色,那么空气就会有颜色;而空气是无色的,所以推测氧气是无色的.”结合你的生活经验,对氮气物理性质进行推测,填写下表:
(2)实验室可用亚硝酸钠(NaNO2)固体和氯化铵(NH4Cl)溶液混和加热来制取氮气.现提供如下实验装置,则实验室制取氮气应采用的发生装置是,收集装置是.(填字母)
(3)工业上常用氮气与氢气在高温、高压及催化剂条件下合成氨气,化学反应方程式为.
N2+3H2 2NH3.现欲制取氨气1.7吨,理论上需要在0℃和标准大气压下的氮气多少升?(已知O℃和标准大气压下氮气的密度为1.25克/升;假设氮气完全转化为氨气)
2NH3.现欲制取氨气1.7吨,理论上需要在0℃和标准大气压下的氮气多少升?(已知O℃和标准大气压下氮气的密度为1.25克/升;假设氮气完全转化为氨气)
(1)请试用这样的推理方法:“如果氧气有颜色,那么空气就会有颜色;而空气是无色的,所以推测氧气是无色的.”结合你的生活经验,对氮气物理性质进行推测,填写下表:
| 颜 色 | 气 味 | 水 溶 性 | |
| 氮 气 |

(3)工业上常用氮气与氢气在高温、高压及催化剂条件下合成氨气,化学反应方程式为.
N2+3H2
 2NH3.现欲制取氨气1.7吨,理论上需要在0℃和标准大气压下的氮气多少升?(已知O℃和标准大气压下氮气的密度为1.25克/升;假设氮气完全转化为氨气)
2NH3.现欲制取氨气1.7吨,理论上需要在0℃和标准大气压下的氮气多少升?(已知O℃和标准大气压下氮气的密度为1.25克/升;假设氮气完全转化为氨气) 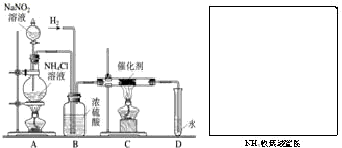 实验室常用亚硝酸钠(NaNO2)与氯化铵溶液(NH4Cl)反应制取N2.N2的化学性质十分稳定,但在一定条件下能与H2部分化合生成NH3.下图为制取少量NH3并检验NH3的装置(制取H2的装置已略去):
实验室常用亚硝酸钠(NaNO2)与氯化铵溶液(NH4Cl)反应制取N2.N2的化学性质十分稳定,但在一定条件下能与H2部分化合生成NH3.下图为制取少量NH3并检验NH3的装置(制取H2的装置已略去):