题目内容
【题目】氯化钾和硝酸钾的部分温度下的溶解度如下表所示:
温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | |
溶解度/g | KCl | 31.0 | 34.0 | 37.0 | 40.0 | 42.6 | 45.5 | 48.3 | 51.1 | 54.0 |
KNO3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 | 169 | 202 | |
(1)两种物质的溶解度随温度变化较大的是 _____。
(2)40℃时氯化钾的饱和溶液中溶质与溶液的质量比为 _____。
(3)M是两种物质中的一种,取35gM进行如下实验:
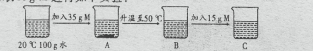
溶质质量分数最大的是____(填字母);属于不饱和溶液的是____(填字母)。
【答案】硝酸钾(或KNO3) 2:7 C BC
【解析】
(1)氯化钾和硝酸钾的溶解度都随温度的升髙而增大,但硝酸钾的溶解度随温度的升高而增大的幅度比氯化钾大。故填:硝酸钾(或KNO3);
(2)40℃时,氯化钾的溶解度为40.0g,即100g水中最多溶解氯化钾40.0g,形成140g饱和溶液,溶质与溶液的质量比为40.0g:140g=2:7。故填:2:7;
(3)20℃时,两种物质的溶解度都小于35g,50℃时两种物质的溶解度都大于35g,但氯化钾的溶解度小于50g,硝酸钾的溶解度大于50g,而C中溶质全部溶解,所以M是硝酸钾,C中100g水中溶解的溶质最多、溶质质量分数最大50℃时硝酸钾的溶解度是85.5g,所以BC均是不饱和溶液。故填:BC。

【题目】下列对一些事实的解释不正确的是![]()
![]()
事实 | 解释 | |
A | 物质的热胀冷缩 | 分子或原子的大小随温度的改变而改变 |
B | 一氧化碳有可燃性,而二氧化碳不具有可燃性 | 物质组成元素虽然相同,但分子结构也不同 |
C | 水电解产生氢气和氧气 | 分子在化学变化中是可以再分的 |
D |
| 一般都不支持燃烧 |
A. A B. B C. C D. D
【题目】小思在实验室发现一瓶瓶塞破损的淡黄色固体,标签标明该固体是过氧化钠。该固体是否已经变质?于是他和同学们进行了以下实验探究:
[查阅资料]
过氧化钠(化学式为Na2O2)是一种淡黄色固体,常用在呼吸面具和潜水中制氧气,其原理为:
2Na2O2+2CO2═2Na2CO3+O2
2Na2O2+2H2O═4NaOH+O2↑
[分析猜想]美奇同学根据观察并结合所给资料判断。该固体中一定还含有Na2O2,理由是_____。
他进一步对固体成份提出了以下猜想:
①只含Na2O2②含Na2CO3和Na2O2两种物质
③含Na2CO3、NaOH两种物质 ④含Na2O2、Na2CO3和NaOH三种物质
[问题分折]请你说明提出猜想③的依据是_____。
[实验探究]为确定该固体的成份,他们又进行了如下实验:
实验方案与步骤 | 实验现象 | 实验结论 |
①取一定量固体于试管中,加入足量蒸馏水,并将带火星木条伸入试管内 | 现象:有气泡产生,木条燃烧程度增强 | 固体中含有Na2O2. |
②将①所得溶液平均分为两份,向第一份溶液中加入足量稀盐酸 | 现象:_____ | 固体中含Na2CO3 |
③向第二份溶液中加入过量的BaCl2溶液,充分反应后取上层清液滴入无色酚酞 | (1)产生白色沉淀;(2)溶液变红 | 固体中含有NaOH |
请写出实验③中产生白色沉淀的化学方程式:_____。
[反思与交流]
有同学认为通过定量计算可确定固体中是否含有NaOH.具体方案如下:①取一定量固体加入到足量的水中,测定产生氧气的质量。②向①中加入足量的CaCl2溶液,通过_____、洗涤、干燥称量产生沉淀质量,进而计算出固体中含Na2CO3的质量。③判断固体中是否含有NaOH。