��Ŀ����
����Ŀ����������ͭ�������ճ������г����ļ��ֽ�����������ѧ֪ʶ�ش�
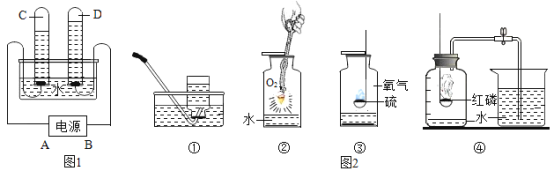
��1�������������õ��Ľ�����Ͻ�����_____����������ϡ������л��߷��Ӳ��ϡ�����
��2�����ڿ�������������Ӧ�����������һ�����ܵ������ﱡĤ���Ӷ���ֹ����һ������������������Ļ�ѧʽΪ_____��
��3�������Ȼ�ͭ���Ȼ�п��ϡ����Ļ����Һ�м���������ۣ���ַ�Ӧ����ˣ���Һ�к��е�������_____��д��ѧʽ����
��4��ұ��2000t �������� 80%�ij�����ʯ���������ܵõ������� 2%��������������_____t�������ȷ�� 0.1����
��5��ͭ�ڿ����л����ͭ�̣���Ҫ�ɷּ�ʽ̼��ͭ[Cu2��OH��2CO3]������ʽ̼��ͭ���ȷֽ���������ͭ��ˮ�Ͷ�����̼������ּ���24g������ͭ�ļ�ʽ̼��ͭ���壬����Ӧǰ�������ͭԪ�ص���������֮��Ϊ3��4����÷�Ӧ����ˮ�Ͷ�����̼������֮��Ϊ_____g��
���𰸡��������� Al2O3 ZnCl2��FeCl2 1142.9 6
��������
��1���������õ��Ľ�����Ͻ����ڽ������ϣ�
��2�����Ϳ����е�������Ӧ�������ܵ���������Ĥ���谭��Ӧ�ļ�����������Ļ�ѧʽΪAl2O3��
��3������ǰ��Ľ������Խ����ں���Ľ������仯�������û����������������Ȼ�ͭ���Ȼ�п��ϡ����Ļ����Һ�м���������ۣ��������Ȼ�ͭ��Ӧ��������������ͭ���������ᷴӦ�����Ȼ����������������Գ�ַ�Ӧ����ˣ���Һ�к��е�������ZnCl2��FeCl2��
��4�����������ܵõ������� 2%��������������x

![]()
x��1142.9t��
��5����ּ���24g������ͭ�ļ�ʽ̼��ͭ���壬��õ�����������ͭ������ͭ��ͭԪ�ص���������Ϊ![]() �����ݷ�Ӧǰ�������ͭԪ�ص���������֮��Ϊ3��4����֪��ӦǰͭԪ�ص���������Ϊ60%����ӦǰͭԪ�ص�����Ϊ24g��60%��14.4g����Ӧ����������Ϊ
�����ݷ�Ӧǰ�������ͭԪ�ص���������֮��Ϊ3��4����֪��ӦǰͭԪ�ص���������Ϊ60%����ӦǰͭԪ�ص�����Ϊ24g��60%��14.4g����Ӧ����������Ϊ![]() ����÷�Ӧ����ˮ�Ͷ�����̼������֮��Ϊ 24g��18g��6g��
����÷�Ӧ����ˮ�Ͷ�����̼������֮��Ϊ 24g��18g��6g��
�ʴ�Ϊ����1���������ϣ���2��Al2O3����3��ZnCl2��FeCl2����4��1142.9����5��6��

 �Ƹ�С״Ԫ�������������ϵ�д�
�Ƹ�С״Ԫ�������������ϵ�д� ����һ������ܼƻ�ϵ�д�
����һ������ܼƻ�ϵ�д�����Ŀ��������ϵ��й����������ϵ��Ȳ��ó����ٴγ�Ϊ����ʩչ���յ���̨���������ʦ�и���������:����ʱ���ּ��Ͼ��ּӴף���ʹ�˱�������ɿڣ�ԭ���Ǵ��е��������Ͼ��е��Ҵ����������������±����Ǽ��ֳ���������������������⣺
�������� | ������� | �������� | ������� | �������� |
��ѧʽ | C2H4O2 | C3H6O2 | C3H6O2 | X |
(1)�������(C2H4O2)��̼Ԫ�ء���Ԫ�ء���Ԫ�ص�������Ϊ _______��
(2)��������(C3H6O2)��̼Ԫ�ص���������Ϊ_______(��������ȷ��0.1%)��
(3)�ȽϹ�����ѧϰ��ѧ����Ҫ�������ݱ��Ʋ�X�Ļ�ѧʽΪ________��