题目内容
化学教师在课堂上做了一个小魔术:吹气生火.只见老师通过一根细长的玻璃管,对着蒸发皿中的一团棉花吹气,不一会,棉花就燃烧起来.同学们觉得很好奇:通常情况下,嘴中呼出的气体是不会使棉花燃烧的.为什么老师对着棉花吹气就能使其燃烧?
同学们已经知道:可燃物的燃烧需要两个条件①______②______;
小娟同学课下询问老师知道了其中的道理:口中吹出的气体中含有一定量的CO2,棉花(实为脱脂棉)中包裹着黄色过氧化钠(Na2O2),CO2与Na2O2反应生成白色的Na2CO3和氧气,同时放出大量的热,最终使棉花燃烧起来.请帮助小娟同学完成下列问题:
(1)写出Na2O2与CO2反应的化学方程式:______.
(2)小娟同学通过查阅资料得知:
①Na2O2不仅能与CO2反应也能够与H2O反应.
②碱石灰中的成分既能吸收水蒸气,又能吸收二氧化碳.
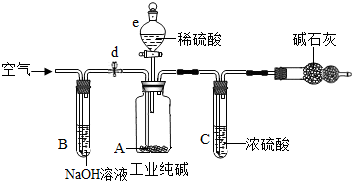
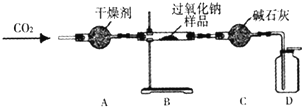
她设计了如图所示装置,来验证Na2O2与CO2反应生成了O2,并测定某过氧化钠样品中Na2O2的质量分数(杂志不参加反应).
实验步骤如下:①连接装置并检查气密性;
②向A-C装置中加入相应的药品,其中B装置内加入过氧化拿样品的质量为9.0g;
③缓慢通入CO2,充分反应后,称得B装置中固体药品的质量为11.8g.
回答下列问题:
a.检验D装置中收集到的气体是氧气的操作是______.
b.A装置的主要作用是______.装置A中干燥及能否使用碱石灰?______(填“能”或“不能”),原因是______
c.装置c的作用是______
d.实验测得该过氧化钠样品中Na2O2的质量分数为______.(精确到0.1%)
同学们已经知道:可燃物的燃烧需要两个条件①______②______;
小娟同学课下询问老师知道了其中的道理:口中吹出的气体中含有一定量的CO2,棉花(实为脱脂棉)中包裹着黄色过氧化钠(Na2O2),CO2与Na2O2反应生成白色的Na2CO3和氧气,同时放出大量的热,最终使棉花燃烧起来.请帮助小娟同学完成下列问题:
(1)写出Na2O2与CO2反应的化学方程式:______.
(2)小娟同学通过查阅资料得知:
①Na2O2不仅能与CO2反应也能够与H2O反应.
②碱石灰中的成分既能吸收水蒸气,又能吸收二氧化碳.
她设计了如图所示装置,来验证Na2O2与CO2反应生成了O2,并测定某过氧化钠样品中Na2O2的质量分数(杂志不参加反应).
实验步骤如下:①连接装置并检查气密性;
②向A-C装置中加入相应的药品,其中B装置内加入过氧化拿样品的质量为9.0g;
③缓慢通入CO2,充分反应后,称得B装置中固体药品的质量为11.8g.
回答下列问题:
a.检验D装置中收集到的气体是氧气的操作是______.
b.A装置的主要作用是______.装置A中干燥及能否使用碱石灰?______(填“能”或“不能”),原因是______
c.装置c的作用是______
d.实验测得该过氧化钠样品中Na2O2的质量分数为______.(精确到0.1%)

可燃物燃烧的条件是:与氧气接触、达到着火点.
故答案为:①温度达到着火点②与氧气接触
(1)通过信息:CO2与Na2O2反应生成白色的Na2CO3和氧气,可知反应方程式是:2CO2+2Na2O2═2Na2CO3+O2.
(2)a、氧气的检验方法,用带火星的木条伸入瓶内,如木条复燃,证明D中收集的是氧气;
b、A装置的作用是净化二氧化碳,即用浓硫酸吸收二氧化碳中的水蒸汽;装置A中干燥剂不能使用碱石灰,因为碱石灰中的成分既能吸收水蒸气,又能吸收二氧化碳;
c、据实验知,B装置中二氧化碳与过氧化钠反应,生成氧气,进入装置C,同时进入装置C的可能还有未反应的二氧化碳,碱石灰中的成分能吸收二氧化碳,故装置C的作用是吸收过量的二氧化碳;
d、设生成11.8g可碳酸钠,要用Xg过氧化钠,
2CO2+2Na2O2═2Na2CO3+O2
156 212
X 11.8g
═
,X=8.68g,
故过氧化钠样品中Na2O2的质量分数为
×100%=96.4%;
故答案为:①温度达到着火点,②与氧气接触;
(1)2CO2+2Na2O2═2Na2CO3+O2;
(2)a、将带火星的木条放在集气瓶中,木条复燃,证明D中收集的是氧气;
b、,不能,碱石灰中的成分既能吸收水蒸气,又能吸收二氧化碳;
c、吸收过量的二氧化碳;
d、96.4%.
故答案为:①温度达到着火点②与氧气接触
(1)通过信息:CO2与Na2O2反应生成白色的Na2CO3和氧气,可知反应方程式是:2CO2+2Na2O2═2Na2CO3+O2.
(2)a、氧气的检验方法,用带火星的木条伸入瓶内,如木条复燃,证明D中收集的是氧气;
b、A装置的作用是净化二氧化碳,即用浓硫酸吸收二氧化碳中的水蒸汽;装置A中干燥剂不能使用碱石灰,因为碱石灰中的成分既能吸收水蒸气,又能吸收二氧化碳;
c、据实验知,B装置中二氧化碳与过氧化钠反应,生成氧气,进入装置C,同时进入装置C的可能还有未反应的二氧化碳,碱石灰中的成分能吸收二氧化碳,故装置C的作用是吸收过量的二氧化碳;
d、设生成11.8g可碳酸钠,要用Xg过氧化钠,
2CO2+2Na2O2═2Na2CO3+O2
156 212
X 11.8g
| 156 |
| 212 |
| X |
| 11.8g |
故过氧化钠样品中Na2O2的质量分数为
| 8.68g |
| 9.0g |
故答案为:①温度达到着火点,②与氧气接触;
(1)2CO2+2Na2O2═2Na2CO3+O2;
(2)a、将带火星的木条放在集气瓶中,木条复燃,证明D中收集的是氧气;
b、,不能,碱石灰中的成分既能吸收水蒸气,又能吸收二氧化碳;
c、吸收过量的二氧化碳;
d、96.4%.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目