题目内容
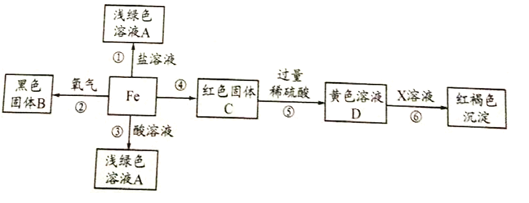
【题目】如图所示,回答下列问题:
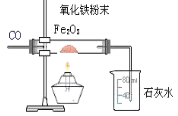
(1)实验开始应先____________ ,目的是____________。
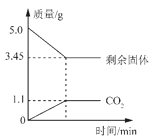
(2)实验中玻璃管内的现象是________ ,发生反应的化学方程式_______。烧杯中石灰水变_______,其反应化学方程式________
(3)实验完毕应先停止后停止_____________ ,目的是________
(4)请指出这位同学所用实验装置的不足之处________。
【答案】先通入一段时间的一氧化碳气体 防止发生爆炸 红色粉末逐渐变为黑色 Fe2O3+3CO![]() 2Fe+3CO2 浑浊 Ca(OH)2+CO2=CaCO3↓+H2O 先停止加热,后停止通入一氧化碳气体 防止生成的铁被氧化 缺少尾气处理装置
2Fe+3CO2 浑浊 Ca(OH)2+CO2=CaCO3↓+H2O 先停止加热,后停止通入一氧化碳气体 防止生成的铁被氧化 缺少尾气处理装置
【解析】
(1)用一氧化碳还原氧化铁的实验中,实验开始应先通入一段时间的一氧化碳气体,然后再给玻璃管中的氧化铁加热,故填先通入一段时间的一氧化碳气体;
先通入一氧化碳气体可以排尽玻璃管中的空气,避免一氧化碳与空气中的氧气在加热的条件下发生爆炸,故填防止发生爆炸。
(2)反应中,一氧化碳夺取氧化铁中的氧,将氧化铁还原为铁,则玻璃管中的现象是红色粉末逐渐变为黑色,故填红色粉末逐渐变为黑色;
一氧化碳与氧化铁在高温的条件下反应生成铁和二氧化碳,故反应的化学方程式写为:Fe2O3+3CO![]() 2Fe+3CO2;
2Fe+3CO2;
实验中,观察到烧杯中的石灰水变浑浊,故填浑浊;
反应生成的二氧化碳与澄清石灰水中的氢氧化钙反应生成碳酸钙沉淀和水,故反应的化学方程式写为:Ca(OH)2+CO2=CaCO3↓+H2O。
(3)实验完毕应先停止加热,后停止通入一氧化碳气体,故填先停止加热,后停止通入一氧化碳气体;
如果先停止通入一氧化碳气体,后停止加热,生成的温度较高的铁会与进入装置内的空气中的氧气发生氧化反应,重新被氧化成氧化铁,故填防止生成的铁被氧化。
(4)装置的末端缺少一氧化碳气体的处理装置,一氧化碳直接排放到空气中会造成空气污染,故填缺少尾气处理装置。

【题目】我市石灰石资源丰富,某课外小组同学为了测定石灰石中碳酸钙的质量分数,取某地石灰石样品10.0g于烧杯中,将100g稀盐酸分5次加入烧杯中,充分反应后(杂质不与稀盐酸反应),测得剩余固体的质量记录如下.
次数 | 1 | 2 | 3 | 4 | 5 |
加入稀盐酸质量/g | 20 | 20 | 20 | 20 | 20 |
剩余固体质量/g | 8.0 | 6.0 | 4.0 | 2.5 | X |
请计算:(1)X的值为__________.
(2)该石灰石样品中碳酸钙的质量分数为_____________
(3)所用稀盐酸溶质的质量分数为________.(写出计算过程)