题目内容
【题目】BaCl2是一种重金属盐,其水溶液具有很强的毒性。若误服了BaCl2溶液可立即服用MgSO4溶液解毒。为了测定某BaCl2溶液的溶质质量分数,现取一定质量的BaCl2溶液,不断滴加MgSO4溶液,反应过程中溶液总质量与加入MgSO4溶液的质量关系如图所示,请回答:
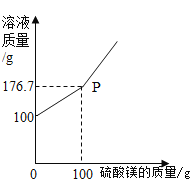
(1)P点时,所得溶液中的阴离子有________(填符号);
(2)反应生成沉淀的最大质量为_________ g;
(3)求原BaCl2溶液的溶质质量分数(保留到0.1%)______。
【答案】Cl- 23.3 20.8%
【解析】
本题涉及的化学方程式为![]() 。
。
(1)由图可知,在P点处为溶液质量变化的“拐点”,则在P点时,溶液中氯化钡和硫酸镁完全发生反应,产生硫酸钡沉淀,该溶液为氯化镁溶液,则阴离子为氯离子,故填![]() ;
;
(2)反应生成沉淀最大质量时,即为P点状态,根据质量守恒可知,最开始时100g氯化钡溶液加入100g硫酸镁溶液后,溶液总质量为176.7g,那么生成硫酸钡质量为100g+100g-176.7g=23.3g,故填23.3;
(3)由(2)得出23.3g硫酸钡,设氯化钡质量为x,那么根据化学方程式反应前后质量守恒得:
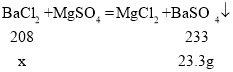
![]()
则氯化钡质量为20.8g,那么原氯化钡溶液溶质质量分数为20.8/100g=20.8%,故填20.8%。

【题目】某化学兴趣小组在实验室做了如图所示的A、B两个实验。

(1)A实验中发生反应的化学方程式为: 。
(2)A、B两个实验结束后,小明同学将两支试管中的物质同时加入一纯净的烧杯中(如图C所示),混合后,观察到烧杯中有蓝色沉淀。同学们将烧杯内的物质过滤,对所得滤液中溶质的成分进行探究。
【猜想】
小明猜想:滤液中的溶质是Na2SO4、CuSO4;
小光猜想:滤液中的溶质是Na2SO4、NaOH;
小英猜想:滤液中的溶质是Na2SO4、CuSO4、H2SO4;
你的猜想:滤液中的溶质还可能是 。
【讨论】你认为 的猜想一定不合理,请说出理由 。
【实验】若小光的猜想正确,请完成下表的方案。
实验步骤 | 预想的实验现象 | 实验结论 |
取少量滤液于试管中,滴入 | 无色溶液变红 | 小光的猜想正确 |
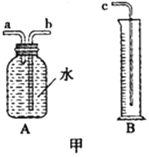
【题目】小敏研究影响锌与盐酸反应快慢的因素。
序号 | 盐酸溶液浓度 | 2分钟内产生氢气的体积 |
1 | 5% | 10mL |
2 | 15% | 28mL |
(1)图甲中A、B仪器可以组装一套测量气体体积的装置,利用该装置时A中的_____管接c。
(2)他选用2克完全相同的锌片分别和同体积5%、15%的稀盐酸进行实验。获得表格数据。由此推断实验是通过______来体现反应快慢的。
(3)小敏分析数据得到如下结论:锌与盐酸反应快慢与盐酸浓度有关,盐酸浓度越大反应越快。其他同学认为结论不可靠,他们的依据是:________。
(4)实验中小敏发现锌与盐酸反应时,一开始产生氢气速度并没有随盐酸浓度的减少而减慢,查阅资料得知化学反应中往往伴随着能量变化。由此作出猜想:锌与盐酸反应快慢还与_______有关。