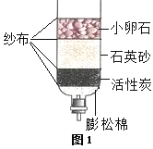
题目内容
【题目】小芳发现,氯酸钾与氧化铜混合加热,也能较快产生氧气,于是进行如下探究:
(提出猜想)除二氧化锰、氧化铜外,氧化铁也可以作氯酸钾分解的催化剂。
(完成实验)按下表进测定分解温度(分解温度越低,催化效果越好)。
实验编号 | 实验药品 | 分解温度(℃) |
① | 氯酸钾 | 580 |
② | 氯酸钾、二氧化锰(质量比1:1) | 350 |
③ | 氯酸钾、氧化铜(质量比l:1) | 370 |
④ | 氯酸钾、氧化铁(质量比1:1) | 390 |
(分析数据、得出结论)(1)由实验__________与实验④对比,证明猜想合理。
(2)实验所用的三种物质,催化效果最好的是_______;
(反思)(1)若要证明氧化铁是该反应的催化剂,还要验证它在化学反应前后___________不变;
(2)同种催化剂,颗粒大小可能影响催化效果,请设计实验方案进行验证________;
(3)同种催化剂,还有_________因素可能影响催化效果。(提示:观察上表)
(4)写出实验编号③反应的表达式___________。
【答案】① 二氧化锰 质量和化学性质 将氯酸钾与不同颗粒大小的同种催化剂等比充分混合,加热测定分解温度 催化剂与反应物的质量比 氯酸钾![]() 氯化钾+氧气
氯化钾+氧气
【解析】
分析数据、得出结论:
(1)根据催化剂能改变化学反应的速率,可选择加催化剂和不加催化剂的进行比较分解温度即可,要想证明除MnO2、CuO外,Fe2O3也可以作KClO3分解的催化剂,可选择实验①和实验④对比,证明猜想合理;
(2)分解时所需温度最低的,催化效果越好,分析表中实验数据可以知道MnO2的催化效果最好;
反思:
(1)催化剂是指在化学反应里能改变其他物质的化学反应速率,而本身的质量和化学性质在化学反应前后都没有发生改变的物质。故要证明Fe2O3是该反应的催化剂,还要验证它在化学反应前后的质量和化学性质不变;
(2)要想证明颗粒大小会影响催化效果,可将氯酸钾与不同颗粒大小的同种催化剂等比充分混合,加热测定分解温度;
(3)通过观察上表发现实验过程中都取用催化剂与反应物相同的质量比进行实验,所以同种催化剂,还有催化剂与反应物的质量比的因素可能影响催化效果;
(4)实验编号③反应是在氧化铜催化作用下,氯酸钾加热分解生成了氯化钾和氧气,反应的文字表达式为:氯酸钾![]() 氯化钾+氧气。
氯化钾+氧气。

【题目】我国古代纺织业常将草木灰(主要成分K2CO3)和生石灰在水中混合,用上层清液漂白织物.
(资料)①K2CO3+Ca(OH)2═CaCO3↓+2KOH②Ca(OH)2,K2CO3和KOH的部分溶解度如下表.
温度/℃ | 0 | 10 | 20 | 30 | 50 | |
溶解度/g | Ca(OH)2 | 0.18 | 0.17 | 0.16 | 0.15 | 0.14 |
k2CO3 | 107 | 109 | 110 | 114 | 121 | |
KOH | 97 | 103 | 112 | 126 | 140 | |
(1)20℃时,100g水中最多可溶解K2CO3的质量是__________g.溶质的质量分数为50%的K2CO3溶液属于________溶液(填“饱和”或“不饱和”)
(2)某温度时,向一定量的饱和氢氧化钙溶液中加入少量生石灰,恢复到原温度,某些量随时间变化的关系如图所示.则纵坐标可能表示的是___________(填序号)
a.溶质的质量 b.溶剂的质量 c.溶液的质量 d.溶质的质量分数 e.氢氧化钙的溶解度.
(3)20℃时,将1.38gK2CO3固体放入100g水中,并加入一定量的氢氧化钙,搅拌使其充分反应,恢复到原温度,过滤,得到质量为1.1g的固体.所得滤液中的溶质是_____,生成碳酸钙的质量是_______g.