题目内容
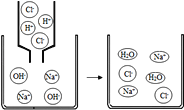
【题目】我国古代纺织业常将草木灰(主要成分K2CO3)和生石灰在水中混合,用上层清液漂白织物.
(资料)①K2CO3+Ca(OH)2═CaCO3↓+2KOH②Ca(OH)2,K2CO3和KOH的部分溶解度如下表.
温度/℃ | 0 | 10 | 20 | 30 | 50 | |
溶解度/g | Ca(OH)2 | 0.18 | 0.17 | 0.16 | 0.15 | 0.14 |
k2CO3 | 107 | 109 | 110 | 114 | 121 | |
KOH | 97 | 103 | 112 | 126 | 140 | |
(1)20℃时,100g水中最多可溶解K2CO3的质量是__________g.溶质的质量分数为50%的K2CO3溶液属于________溶液(填“饱和”或“不饱和”)
(2)某温度时,向一定量的饱和氢氧化钙溶液中加入少量生石灰,恢复到原温度,某些量随时间变化的关系如图所示.则纵坐标可能表示的是___________(填序号)
a.溶质的质量 b.溶剂的质量 c.溶液的质量 d.溶质的质量分数 e.氢氧化钙的溶解度.
(3)20℃时,将1.38gK2CO3固体放入100g水中,并加入一定量的氢氧化钙,搅拌使其充分反应,恢复到原温度,过滤,得到质量为1.1g的固体.所得滤液中的溶质是_____,生成碳酸钙的质量是_______g.
【答案】110 不饱和 ac 氢氧化钾和氢氧化钙 1
【解析】
(1)由图表可知20℃时,K2CO3的溶解度为110g,所以20℃时,100g水中最多可溶解K2CO3的质量是110g,故填110;
20℃时,K2CO3的饱和溶液的溶质质量分数为![]() ×100%≈52.4%>50%,20℃时,溶质的质量分数为50%的K2CO3溶液属于不饱和溶液,故填不饱和。
×100%≈52.4%>50%,20℃时,溶质的质量分数为50%的K2CO3溶液属于不饱和溶液,故填不饱和。
(2)氧化钙能与水反应放出大量的热,氢氧化钙的溶解度随温度的升高而减小,当温度升高时,氢氧化钙在水中的溶解度减小,所以溶质质量逐渐减小。由于氧化钙与水反应消耗一部分水,所以溶质的质量比开始时溶质质量要减小;当温度逐渐降低时,氢氧化钙的溶解度增大,溶解的溶质逐渐增多;故可以表示溶质质量的变化;
溶液是由溶质和溶剂组成的,溶液的质量随溶质和溶剂质量的改变而改变,所以还可以表示溶液质量的变化,故填ac。
(3)解:设1.38g碳酸钾能生成沉淀的质量质量为x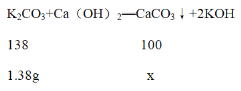
![]() =
=![]()
x=1g
反应后实际得到了1.1g固体,说明固体中还有没溶解的氢氧化钙,则加入的氢氧化钙的量有剩余,碳酸钾全部参加反应,生成了氢氧化钾,所以溶质为氢氧化钾和氢氧化钙,故填氢氧化钾和氢氧化钙;
由上述计算可知生成碳酸钙的质量是1g,故填1。

 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案【题目】请从A或B两题中任选1个作答,若两题均作答,按A计分。
A | B |
(1)该反应的化学方程式为_____。 (2)用排水集气法收集O2的原因 是______。 |
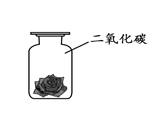
将紫色石蕊溶液浸泡并晾干的小花,一半喷水后放入集气瓶中,实验的现象是______,该实验中主要化学方程式是______。 |
【题目】小芳发现,氯酸钾与氧化铜混合加热,也能较快产生氧气,于是进行如下探究:
(提出猜想)除二氧化锰、氧化铜外,氧化铁也可以作氯酸钾分解的催化剂。
(完成实验)按下表进测定分解温度(分解温度越低,催化效果越好)。
实验编号 | 实验药品 | 分解温度(℃) |
① | 氯酸钾 | 580 |
② | 氯酸钾、二氧化锰(质量比1:1) | 350 |
③ | 氯酸钾、氧化铜(质量比l:1) | 370 |
④ | 氯酸钾、氧化铁(质量比1:1) | 390 |
(分析数据、得出结论)(1)由实验__________与实验④对比,证明猜想合理。
(2)实验所用的三种物质,催化效果最好的是_______;
(反思)(1)若要证明氧化铁是该反应的催化剂,还要验证它在化学反应前后___________不变;
(2)同种催化剂,颗粒大小可能影响催化效果,请设计实验方案进行验证________;
(3)同种催化剂,还有_________因素可能影响催化效果。(提示:观察上表)
(4)写出实验编号③反应的表达式___________。