题目内容
初中化学课上,同学们已经学了一些气体的实验室制法.某同学设计了下图所示装置,准备制取下表所示的三种干燥、纯净的气体.图中铁架台铁夹均已略去,收集装置也未画出,A、B、C、D表示相应仪器加入的试剂.| 气体 | A | B | C | D | 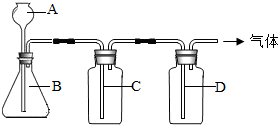 |
| O2 | 双氧水 | 二氧化锰 | 水 | 苛性钠固体 | |
| H2 | 稀硫酸 | 铜 | NaOH溶液 | 浓硫酸 | |
| CO2 | 稀盐酸 | 大理石 | NaOH溶液 | 浓硫酸 |
(2)上述方法中,有的能制得干燥、纯净的气体,有的不能制得干燥纯净的气体.能制得干燥、纯净气体的化学方程式是
(3)已知溶质质量分数为98%的浓硫酸的密度为1.84g/mL.现要配制10%的稀硫酸1960g用作学生分组实验,则需要浓硫酸多少毫升?同时需要水多少毫升?(水的密度约为1g/cm3).
分析:(1)熟悉常见化学仪器,了解名称;
(2)图中三种方法中铜不与酸反应,大理石与稀盐酸反应生成的二氧化碳被氢氧化钠溶液吸收.据此判断.
(3)根据要制得的稀硫酸的总量,计算出所需纯硫酸的量;然后再计算出需要98%的浓硫酸是多少;浓硫酸的密度为1.84g/mL计算出所需浓硫酸的体积;再根据再用总量减去所需要98%的浓硫酸的量;再根据m=v×ρ计算出所需水的体积.
(2)图中三种方法中铜不与酸反应,大理石与稀盐酸反应生成的二氧化碳被氢氧化钠溶液吸收.据此判断.
(3)根据要制得的稀硫酸的总量,计算出所需纯硫酸的量;然后再计算出需要98%的浓硫酸是多少;浓硫酸的密度为1.84g/mL计算出所需浓硫酸的体积;再根据再用总量减去所需要98%的浓硫酸的量;再根据m=v×ρ计算出所需水的体积.
解答:解:(1)熟悉常见化学仪器,了解名称.故答案为:长颈漏斗;
(2)根据所学知识可知,铜是排在氢后的金属,不能与酸反应.大理石与稀盐酸反应生成的二氧化碳,氢氧化钠溶液易吸收二氧化碳.所以这两种反应都不可得到干燥、纯净的气体.只有双氧水与二氧化锰反应制取的氧气,用排水法(可得到较为纯净的氧气)收集,可用苛性钠干燥后得到干燥、纯净的气体.
故答案为:2H2O2
2H2O+O2↑、铜不与酸反应、大理石与稀盐酸反应生成的二氧化碳被氢氧化钠溶液吸收;
(3)解:1960g10%的稀硫酸中含的纯硫酸:
1960×10%=196g
需要98%的浓硫酸:
196÷98%=200g
又因为98%的浓硫酸的密度为1.84g/mL,所以所需浓硫酸的体积是:
200÷1.84=108.7ml
需要水:
1960-200=1760g
又因水的密度约为1g/cm3.根据m=v×ρ
1760=1v
v=1760ml
答:需要98%的浓硫酸108.7ml;需水1760ml.
(2)根据所学知识可知,铜是排在氢后的金属,不能与酸反应.大理石与稀盐酸反应生成的二氧化碳,氢氧化钠溶液易吸收二氧化碳.所以这两种反应都不可得到干燥、纯净的气体.只有双氧水与二氧化锰反应制取的氧气,用排水法(可得到较为纯净的氧气)收集,可用苛性钠干燥后得到干燥、纯净的气体.
故答案为:2H2O2
| ||
(3)解:1960g10%的稀硫酸中含的纯硫酸:
1960×10%=196g
需要98%的浓硫酸:
196÷98%=200g
又因为98%的浓硫酸的密度为1.84g/mL,所以所需浓硫酸的体积是:
200÷1.84=108.7ml
需要水:
1960-200=1760g
又因水的密度约为1g/cm3.根据m=v×ρ
1760=1v
v=1760ml
答:需要98%的浓硫酸108.7ml;需水1760ml.
点评:本题主要考查气体的干燥、化学方程式的书写、以化学的相关计算.属于难度较大的问题.

练习册系列答案
相关题目