题目内容
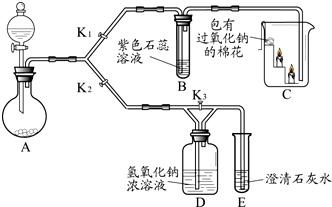
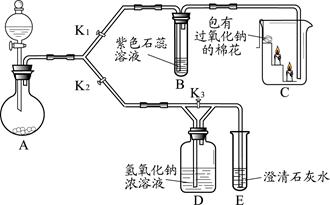
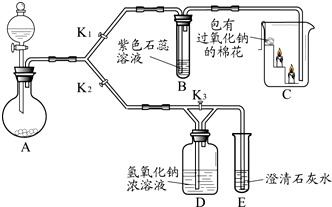
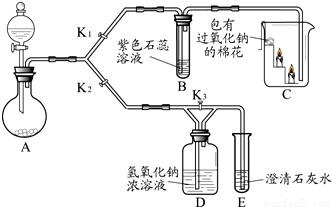
(7分)某兴趣小组的同学利用下图装置研究二氧化碳的性质。(仪器的固定装置已经省略)

(1)A装置用于实验室制取二氧化碳,其反应的化学方程式为 。
(2)实验开始后,关闭K2、打开K1,可观察到B中现象为 ;C中的蜡烛由下至上依次熄灭,说明二氧化碳具有的性质是 ;待蜡烛熄灭后,铁片上的棉花剧烈燃烧起来,由此可得到的推论是 。
(3) 实验开始后,关闭K1和K3,打开K2,观察E中现象,然后打开K3,再观察E中现象,其不同之处是 ,有关反应的方程式为 。
(1)CaCO3 + 2HCl CaCl2 + H2O + CO2↑
(2)紫色石蕊溶液变红
二氧化碳本身不燃烧也不支持燃烧,密度比空气大。
过氧化钠与二氧化碳反应生成氧气并放出热量。
(3)关闭K3 时E中无现象,打开K3 时E中溶液变浑浊。
2NaOH + CO2 Na2CO3 + H2O Ca(OH)2 + CO2 CaCO3↓ + H2O
(2分)写出1个给1分。
【解析】
试题分析:(1)A装置用于实验室制取二氧化碳,其反应的化学方程式为CaCO3 + 2HCl CaCl2 + H2O + CO2↑;
(2)实验开始后,关闭K2、打开K1,可观察到B中现象为紫色石蕊溶液变红;C中的蜡烛由下至上依次熄灭,说明二氧化碳具有的性质是二氧化碳本身不燃烧也不支持燃烧,密度比空气大。待蜡烛熄灭后,铁片上的棉花剧烈燃烧起来,由此可得到的推论是过氧化钠与二氧化碳反应生成氧气并放出热量。
(3) 实验开始后,关闭K1和K3,打开K2,因反应产生的二氧化碳被浓氢氧化钠溶液吸收,故观察E中现象时没有明显现象;然后打开K3,则反应产生的二氧化碳通入澄清石灰水,再观察E中现象,可以看到澄清石灰水变浑浊。有关反应的方程式为2NaOH + CO2 Na2CO3 + H2O 和Ca(OH)2 + CO2 CaCO3↓ + H2O。
考点:实验室制取二氧化碳的原理;化学方程式;二氧化碳的性质;化学反应中的现象。
点评:解答本题的关键是读懂题中图示的意思,按照图示顺序来分析各个步骤的反应现象和本质。