题目内容
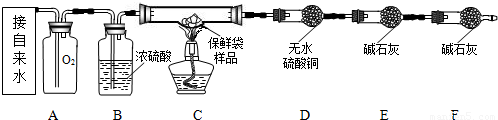
(2011?大兴区二模)某兴趣小组的同学利用下图装置研究二氧化碳的性质.(仪器的固定装置已经省略)
(1)A装置用于实验室制取二氧化碳,其反应的化学方程式为______.
(2)实验开始后,关闭K2、打开K1,可观察到B中现象为______;C中的蜡烛由下至上依次熄灭,说明二氧化碳具有的性质是______;待蜡烛熄灭后,铁片上的棉花剧烈燃烧起来,由此可得到的推论是______.
(3)实验开始后,关闭K1和K3,打开K2,观察E中现象,然后打开K3,再观察E中现象,其不同之处是______,有关反应的方程式为______.
【答案】分析:(1)A装置是“固液不加热”装置,用于实验室制取二氧化碳;
(2)二氧化碳不燃烧,也不支持燃烧,密度比空气大,溶于水,水溶液呈酸性;
(3)二氧化碳可与碱反应生成盐和水,常用澄清石灰水来检验二氧化碳.
解答:解:(1)实验室常用大理石与稀盐酸反应来制取二氧化碳,化学方程式为,CaCO3+2HCl═CaCl2+H2O+CO2↑;
(2)二氧化碳溶于水生成碳酸,碳酸在溶液中电离出氢离子,溶液呈酸性,能使紫色石蕊试液变红;二氧化碳不燃烧也不支持燃烧,密度比空气大,所以C中的蜡烛由上到下依次熄灭;二氧化碳与过氧化钠反应生成氧气并放出热量,蜡烛熄灭后,铁片上的棉花剧烈燃烧;
(3)关闭K1和K3,打开K2,二氧化碳通入氢氧化钠溶液,与氢氧化钠反应,此时E中没有现象;打开K3,二氧化碳通入澄清石灰水,生成碳酸钙沉淀,使澄清石灰水变浑浊;有关反应的化学反方程式为,2NaOH+CO2═Na2CO3+H2O,
Ca(OH)2+CO2═CaCO3↓+H2O.
故答案为:
(1)CaCO3+2HCl═CaCl2+H2O+CO2↑;
(2)紫色石蕊溶液变红;二氧化碳本身不燃烧也不支持燃烧,密度比空气大;过氧化钠与二氧化碳反应生成氧气并放出热量;
(3)关闭K3时E中无现象,打开K3时E中溶液变浑浊;
2NaOH+CO2═Na2CO3+H2O,Ca(OH)2+CO2═CaCO3↓+H2O.
点评:本题主要考查二氧化碳的反应原理、制取装置;掌握二氧化碳的化学性质;了解反应现象和本质的联系.
(2)二氧化碳不燃烧,也不支持燃烧,密度比空气大,溶于水,水溶液呈酸性;
(3)二氧化碳可与碱反应生成盐和水,常用澄清石灰水来检验二氧化碳.
解答:解:(1)实验室常用大理石与稀盐酸反应来制取二氧化碳,化学方程式为,CaCO3+2HCl═CaCl2+H2O+CO2↑;
(2)二氧化碳溶于水生成碳酸,碳酸在溶液中电离出氢离子,溶液呈酸性,能使紫色石蕊试液变红;二氧化碳不燃烧也不支持燃烧,密度比空气大,所以C中的蜡烛由上到下依次熄灭;二氧化碳与过氧化钠反应生成氧气并放出热量,蜡烛熄灭后,铁片上的棉花剧烈燃烧;
(3)关闭K1和K3,打开K2,二氧化碳通入氢氧化钠溶液,与氢氧化钠反应,此时E中没有现象;打开K3,二氧化碳通入澄清石灰水,生成碳酸钙沉淀,使澄清石灰水变浑浊;有关反应的化学反方程式为,2NaOH+CO2═Na2CO3+H2O,
Ca(OH)2+CO2═CaCO3↓+H2O.
故答案为:
(1)CaCO3+2HCl═CaCl2+H2O+CO2↑;
(2)紫色石蕊溶液变红;二氧化碳本身不燃烧也不支持燃烧,密度比空气大;过氧化钠与二氧化碳反应生成氧气并放出热量;
(3)关闭K3时E中无现象,打开K3时E中溶液变浑浊;
2NaOH+CO2═Na2CO3+H2O,Ca(OH)2+CO2═CaCO3↓+H2O.
点评:本题主要考查二氧化碳的反应原理、制取装置;掌握二氧化碳的化学性质;了解反应现象和本质的联系.

练习册系列答案
 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案
相关题目