题目内容
碳酸钠和氯化钙溶液反应不仅可以用Na2CO3+CaCl2=CaCO3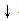 +2NaCl表示,还可以用 CO32﹣+Ca2+=CaCO3
+2NaCl表示,还可以用 CO32﹣+Ca2+=CaCO3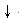 表示,后者叫离子方程式.书写离子方程式时按以下步骤进行:①“写”:写出化学方程式.(Na2CO3+CaCl2=CaCO3
表示,后者叫离子方程式.书写离子方程式时按以下步骤进行:①“写”:写出化学方程式.(Na2CO3+CaCl2=CaCO3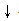 +2NaCl)
+2NaCl)
②“拆”:将易溶易解离的酸、碱和盐拆写成离子形式;沉淀、气体和水仍用化学式表示,不能拆写成离子形式.(2Na+ +CO3 2﹣+Ca 2+ +2Cl﹣=CaCO 3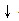 +2Na + +2Cl﹣)
+2Na + +2Cl﹣)
③“删”:删去方程式左右两边相同的离子.(CO32﹣+Ca2+ =CaCO3 )
)
④“查”:检查方程式左右两边各元素的原子个数和电荷总数是否相等.
注意:离子方程式中生成物为沉淀或气体时需标出“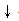 ”或“↑”.
”或“↑”.
根据以上信息,结合已学知识,回答下列问题:
(1)HCl在水中解离出 (填离子符号);NaOH在水中解离出 (填离子符号).
(2)CaCO3+2HCl=CaCl 2+CO2↑+H2O的离子方程式是 .
(1)H+和Cl﹣;Na+和OH﹣
(2)CaCO3+2H+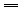 2Ca2+ +CO2↑+H2O.
2Ca2+ +CO2↑+H2O.
(2)CaCO3+2H+
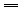 2Ca2+ +CO2↑+H2O.
2Ca2+ +CO2↑+H2O.
练习册系列答案
 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案
相关题目
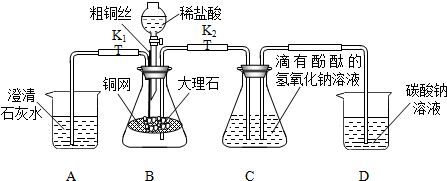
工业用碳酸钠溶液与石灰水反应制烧碱.对于碳酸钠溶液与石灰水是否恰好完全反应,化学小组同学将其产物进行过滤,并对滤液进行如下探究.
提出假设:假设一:滤液中只含氢氧化钠
假设二:滤液中含氢氧化钠和氢氧化钙
假设三:滤液中含氢氧化钠和碳酸钠
假设四:滤液中含氢氧化钠、氢氧化钙和碳酸钠
甲同学设计了如下实验方案:已知:Na2CO3+CaCl2=2NaCl+CaCO3↓(白色)
试回答:
(1)写出碳酸钠溶液与石灰水反应的化学方程式 .
(2)哪种假设不合理,试说明理由 .
(3)乙同学认为甲同学设计方案还不能说明碳酸钠溶液和澄清石灰水恰好完全反应,她的理由
是 .
(4)丙同学认为要说明碳酸钠溶液与石灰水是否恰好完全反应,还需在甲同学实验方案的基础
上进行实验.她的实验方案是:
(5)取18.6g氢氧化钠样品(样品中的杂质是碳酸钠),加水溶解得到溶液A,取A溶液的1/10向其中逐滴加入一定浓度的稀盐酸,并同时记录放出CO2的质量和消耗盐酸的质量(所得数据如图).试计算:

①盐酸中溶质的质量分数为 %.
②样品中碳元素的质量分数为 %.
提出假设:假设一:滤液中只含氢氧化钠
假设二:滤液中含氢氧化钠和氢氧化钙
假设三:滤液中含氢氧化钠和碳酸钠
假设四:滤液中含氢氧化钠、氢氧化钙和碳酸钠
甲同学设计了如下实验方案:已知:Na2CO3+CaCl2=2NaCl+CaCO3↓(白色)
| 实验步骤 | 实验现象 | 结论 |
| 取少量滤液放在试管中,再滴入氯化钙溶液 | 若生成白色沉淀 | 碳酸钠过量 |
| 若无明显现象 | 恰好反应 |
(1)写出碳酸钠溶液与石灰水反应的化学方程式
(2)哪种假设不合理,试说明理由
(3)乙同学认为甲同学设计方案还不能说明碳酸钠溶液和澄清石灰水恰好完全反应,她的理由
是
(4)丙同学认为要说明碳酸钠溶液与石灰水是否恰好完全反应,还需在甲同学实验方案的基础
上进行实验.她的实验方案是:
| 实验步骤 | 实验现象和结论 |

①盐酸中溶质的质量分数为
②样品中碳元素的质量分数为
 21、化学调研小组的同学用氢氧化钠和稀盐酸探究中和反应,请你参与以下探究:
21、化学调研小组的同学用氢氧化钠和稀盐酸探究中和反应,请你参与以下探究:

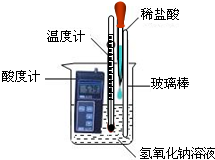 化学调研小组的同学用氢氧化钠和稀盐酸探究中和反应,请你参与以下探究:
化学调研小组的同学用氢氧化钠和稀盐酸探究中和反应,请你参与以下探究: