题目内容
【题目】某学校实验开放日,化学兴趣小组进行了以下实验探究。
实验探究一:
I.探究酸和碱能否发生反应
方案1:甲同学向盛有少量NaOH溶液的试管中滴几滴无色酚酞试液,振荡,继续加入稀硫酸,观察到(__________)现象时才能得出酸和碱能发生反应的结论。
方案2:乙同学取少量NaOH溶液,测得溶液pH为10,向该溶液中加入一定量稀硫酸后,测得溶液pH为9,乙同学发现溶液pH减小了,得出结论:酸和碱能发生反应。
交流讨论:大家同意甲同学的结论,对乙同学的实验过程提出质疑,溶液pH减小的原因还可能是稀硫酸中的水稀释了NaOH溶液:大家认为,乙同学向NaOH溶液中加入稀硫酸后,测得溶液的pH必须(__________)才能证明酸和碱能发生反应。
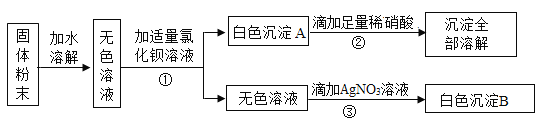
Ⅱ.探究酸和碱反应后溶液中溶质的成分丙同学对探究![]() 中甲同学实验后的无色溶液展开探究。
中甲同学实验后的无色溶液展开探究。
(提出问题)试管中无色溶液的溶质除了酚酞还有什么?
(进行猜想)(l)Na2SO4;(2)Na2SO4和H2SO4;(3)Na2SO4和NaOH
同学们对猜想(3)提出了疑问,原因是![]() ____
____![]()
(设计实验)
实验操作 | 实验现象 | |
方案1 | 向试管中加入少量锌粒,然后加入甲同学实验后的无色溶液 | 锌粒逐渐减少,有产生气泡 |
方案2 | 向试管中加入少量甲同学实验后的无色溶液,然后慢慢滴加NaOH溶液,并不断振荡试管 | 开始无明显现象,过一会发现 |
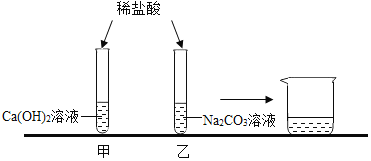
实验探究二:如图1
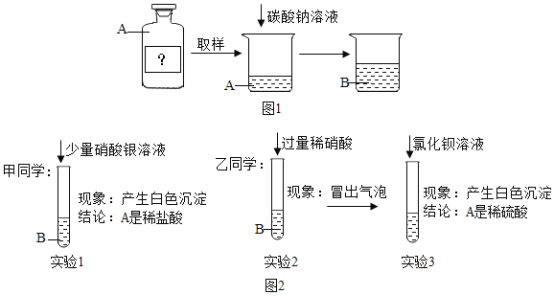
确定未知溶液A是稀盐酸还是稀硫酸。
实验如下:
(提出问题)A是哪一种酸?老师要求甲、乙同学从反应后的溶液B分别展开探究。
(猜想假设)甲同学:A是稀盐酸:乙同学:![]() 是稀硫酸
是稀硫酸
(实验探究)如图2
(评价交流)
下列对于甲、乙两同学的实验分析正确的是(__________)
A.甲同学的实验方案和结论正确:实验3所得溶液中可能含有H+、NO3-、C1-、Na+
B.甲同学的实验方案和结论正确:实验3所得溶液中一定含有H+、NO3-、C1-、Na+
C.乙同学的实验方案和结论正确:实验3所得溶液中可能含有H+、NO3-、C1-、Na+
D.乙同学的实验方案和结论正确:实验3所得溶液中一定含有H+、NO3-、C1-、Na+
(归纳总结)
对比甲、乙两位同学的实验,我们能够总结出。除去溶液中干扰离子的一般方法是:选择试剂将干扰离子变成________除去。
【答案】溶液由无色变成红色 等于或小于7 试管中是无色溶液,因此不含有氢氧化钠 溶液由无色变成红色 D 沉淀或气体或水
【解析】
实验探究一:探究酸和碱能否发生反应
方案1:甲同学向盛有少量NaOH溶液的试管中滴几滴无色酚酞试液,溶液变红色,振荡,继续加入稀硫酸,观察到溶液由红色变成无色,说明酸和碱能发生反应;
故填:溶液由红色变成无色。
方案2:乙同学向NaOH溶液中加入稀硫酸后,测得溶液的pH必须小于或等于7,才能证明酸和碱能发生反应,这是因为pH小于7,说明氢氧化钠已经完全反应并且硫酸过量,等于7,说明氢氧化钠恰好和硫酸完全反应;
故填:等于或小于7。
进行猜想:
氢氧化钠溶液使无色酚酞溶液变红,同学们对猜想(3)提出了疑问,原因是试管中是无色溶液,因此不含有氢氧化钠;
设计实验:
方案2:若猜想(2)成立,即反应后的溶液中存在硫酸钠和硫酸,向试管中加入少量甲同学实验后的无色溶液,然后慢慢滴加NaOH溶液,并不断振荡试管,氢氧化钠将其中的硫酸中和,继续滴加氢氧化钠,溶液显碱性,无色的酚酞试液变红色;
故填:溶液由无色变成红色。
实验探究二:
评价交流:
甲同学的实验中将反应后的溶液中加入硝酸银溶液后生成白色沉淀,就认定A为稀盐酸,其实因为反应后的溶液中有碳酸根离子,生成的白色沉淀是碳酸银,故不能证明A为稀盐酸;乙同学的实验中先在反应后的溶液中加入稀硝酸,把碳酸根离子除去,然后加入氯化钡溶液,生成白色沉淀硫酸钡,从而证明A为稀硫酸,过程正确,能得出正确结论;在实验3中的反应物是氯化钡和硫酸钠,反应生成硫酸钡和氯化钠,其反应的化学方程式![]() ;由实验及反应物、生成物可知,反应后的溶液中有氢离子、硝酸根离子、钠离子和氯离子;即乙同学的实验方案和结论正确:实验3所得溶液中一定含有H+、NO3-、C1-、Na+,故D正确;
;由实验及反应物、生成物可知,反应后的溶液中有氢离子、硝酸根离子、钠离子和氯离子;即乙同学的实验方案和结论正确:实验3所得溶液中一定含有H+、NO3-、C1-、Na+,故D正确;
故填:D。