题目内容
【题目】有一包固体粉末,可能是由硫酸铜、氯化钠、碳酸钠、硫酸钠中的一种或几种组成,为检验其中的成分,按以下流程进行实验:
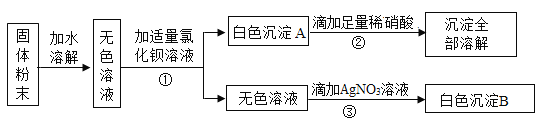
(1)白色沉淀A的化学式为___________。
(2)根据实验现象,固体粉末中一定有___________,一定没有___________。
(3)要确定可能有的物质是否存在,只需对上述流程中的哪一步进行如何改进___________________。
【答案】BaCO3 Na2CO3 CuSO4、Na2SO4 将BaCl2溶液换成Ba(NO3)2溶液
【解析】
(1)根据所学知识和题中信息知,白色粉末遇水呈无色溶液,则一定没有硫酸铜,因为硫酸铜水溶液呈蓝色。无色溶液加适量氯化钡有白色沉淀,可能有碳酸钠、硫酸钠中的一种或两种。白色沉淀加硝酸全部溶解,则一定没有硫酸钠,因为硫酸钡不溶于硝酸;所以一定有碳酸钠。无色溶液进入硝酸银和硝酸产生白色沉淀,也不一定有氯化钠,因为先前加入氯化钡引入了氯离子,与硝酸银反应生成不溶于硝酸的白色沉淀可能是氯化钡引入的氯离子不一定就是氯化钠中的氯离子。根据上述分析可知白色沉淀A是碳酸钡,故填:BaCO3。
(2)根据上述分析可知固体粉末中一定有碳酸钠,一定没有硫酸铜、硫酸钠,可能有氯化钠。故填:Na2CO3;CuSO4、Na2SO4。
(3)根据上述分析可知无法检验出氯化钠的存在是因为在先前加入试剂时引入了氯离子,所以我们要将BaCl2溶液换成Ba(NO3)2溶液,这样就不会干扰氯化钠的检验了。故填:将BaCl2溶液换成Ba(NO3)2溶液。

 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案【题目】某学校实验开放日,化学兴趣小组进行了以下实验探究。
实验探究一:
I.探究酸和碱能否发生反应
方案1:甲同学向盛有少量NaOH溶液的试管中滴几滴无色酚酞试液,振荡,继续加入稀硫酸,观察到(__________)现象时才能得出酸和碱能发生反应的结论。
方案2:乙同学取少量NaOH溶液,测得溶液pH为10,向该溶液中加入一定量稀硫酸后,测得溶液pH为9,乙同学发现溶液pH减小了,得出结论:酸和碱能发生反应。
交流讨论:大家同意甲同学的结论,对乙同学的实验过程提出质疑,溶液pH减小的原因还可能是稀硫酸中的水稀释了NaOH溶液:大家认为,乙同学向NaOH溶液中加入稀硫酸后,测得溶液的pH必须(__________)才能证明酸和碱能发生反应。
Ⅱ.探究酸和碱反应后溶液中溶质的成分丙同学对探究![]() 中甲同学实验后的无色溶液展开探究。
中甲同学实验后的无色溶液展开探究。
(提出问题)试管中无色溶液的溶质除了酚酞还有什么?
(进行猜想)(l)Na2SO4;(2)Na2SO4和H2SO4;(3)Na2SO4和NaOH
同学们对猜想(3)提出了疑问,原因是![]() ____
____![]()
(设计实验)
实验操作 | 实验现象 | |
方案1 | 向试管中加入少量锌粒,然后加入甲同学实验后的无色溶液 | 锌粒逐渐减少,有产生气泡 |
方案2 | 向试管中加入少量甲同学实验后的无色溶液,然后慢慢滴加NaOH溶液,并不断振荡试管 | 开始无明显现象,过一会发现 |
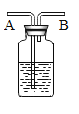
实验探究二:如图1
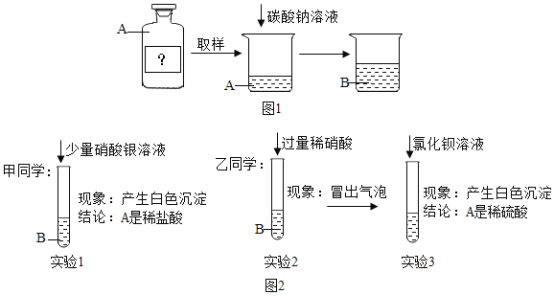
确定未知溶液A是稀盐酸还是稀硫酸。
实验如下:
(提出问题)A是哪一种酸?老师要求甲、乙同学从反应后的溶液B分别展开探究。
(猜想假设)甲同学:A是稀盐酸:乙同学:![]() 是稀硫酸
是稀硫酸
(实验探究)如图2
(评价交流)
下列对于甲、乙两同学的实验分析正确的是(__________)
A.甲同学的实验方案和结论正确:实验3所得溶液中可能含有H+、NO3-、C1-、Na+
B.甲同学的实验方案和结论正确:实验3所得溶液中一定含有H+、NO3-、C1-、Na+
C.乙同学的实验方案和结论正确:实验3所得溶液中可能含有H+、NO3-、C1-、Na+
D.乙同学的实验方案和结论正确:实验3所得溶液中一定含有H+、NO3-、C1-、Na+
(归纳总结)
对比甲、乙两位同学的实验,我们能够总结出。除去溶液中干扰离子的一般方法是:选择试剂将干扰离子变成________除去。