题目内容
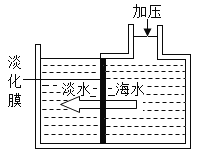
【题目】氯酸钾和二氧化锰的混合物制取氧气如图,分析不正确的是 ( )
A.反应结束时一定能收集到![]() 氧气
氧气
B.P点处固体成分是氯酸钾和氯化钾
C.在氯酸钾分解过程中氯元素的质量分数不断增大
D.在![]() 时段,
时段,![]() 在混合物中的质量分数不断增大
在混合物中的质量分数不断增大
【答案】B
【解析】
A、由图可知,反应前固体的质量为a,反应后的固体质量为b,所以反应生成的氧气的质量为(ab)g,选项正确,不符合题意;
B、由图可知,P点时氯酸钾并没有完全反应,所以此时固体成分是氯酸钾、氯化钾和二氧化锰,选项错误,符合题意;
C、在氯酸钾分解过程中,固体的质量逐渐减少,而氯元素在固体中的质量不变,所以氯元素的质量分数不断增大,选项正确,不符合题意;
D、在![]() 时段,MnO2的质量不变,而固体的质量逐渐减少,所以MnO2在混合物中的质量分数不断增大,选项正确,不符合题意,故选B。
时段,MnO2的质量不变,而固体的质量逐渐减少,所以MnO2在混合物中的质量分数不断增大,选项正确,不符合题意,故选B。

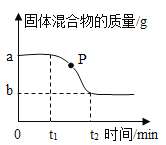
【题目】在宏观、微观和符号之间建立联系是化学学科的特点。甲和乙反应生成丙和丁的化学方程式用下列微观示意图表示:
物质 | 甲 | 乙 | 丙 | 丁 |
|
微观 示意图 |
| ||||
①请写出丙物质的化学式_____;下列属于丁物质的微观示意图的是_____。
②能保持甲化学性质的微粒是_____(填“分子”或“原子”),四种物质中属于氧化物的有_____(填甲、乙、丙、丁)。
③从上述反应重能获得的信息有_____(填一条即可)。
④上述微观示意图表示的化学方程式是:_____。
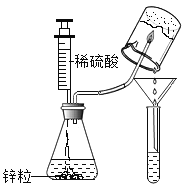
【题目】某同学在做“氢气在空气中燃烧”实验时,对生成物的成分产生了质疑:水和过氧化氢具有相同的组成元素,那么氢气在空气中燃烧除生成水外,是否还有过氧化氢生成呢?带着疑问,该同学利用如图所示实验装置进行了以下探究。
(提出猜想)氢气在空气中燃烧除生成水,还有过氧化氢生成。
(查阅资料)
①在一定条件下(低温环境下),氢气在空气中燃烧除生成水外,还有过氧化氢生成。
②过氧化氢溶液能使无色的淀粉碘化钾溶液变蓝色。
③低温时过氧化氢难分解
(实验探究)
主要步骤 | 主要现象 | 实验结论 |
Ⅰ.将注射器内的稀硫酸注入到盛有锌粒的锥形瓶中 | 在锌粒表面有______产生 | 反应的化学方程式为___________ |
Ⅱ.点燃经验纯后的氢气,用底部结有冰的小烧杯罩在火焰上方,用漏斗和试管收集所得液体。向试管中加入______。 | 氢气燃烧产生淡蓝色火焰,试管中液体由无色变_____色 | 氢气在空气中燃烧有过氧化氢生成 |
(反思评价)实验中将氢气燃烧的火焰对着冰,冰的作用是______。
A创设低温环境,使部分氢气燃烧产生一定量的过氧化氢
B使生成的过氧化氢溶入冰融化成的水中,便于收集
C有利于防止生成的过氧化氢分解
(拓展分析)除氢气和氧气反应会生成两种氧化物外,金属钠也具有类似的化学性质。钠常温露置在空气中与氧气反应生成氧化钠,钠在空气中燃烧生成过氧化钠(Na2O2);造成反应物相同,生成物不同的原因是________。
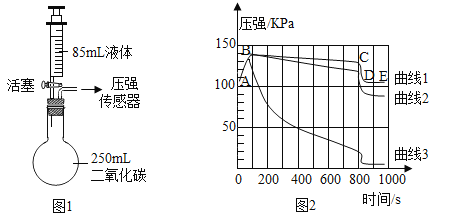
【题目】中和反应是一类重要的化学反应:
①能与稀硫酸发生中和反应的_____________
A 氢氢化钡 B 碳酸钠 C 镁带 D 氧化铜
②小组同学将氢氧化钠溶液和稀盐酸混合反应。实验装置如图,采用无色酚酞试液作酸碱指示剂,用传感器分别测定溶液pH、溶液温度的变化情况。请写出该中和反应的化学方程式:____________。根据表格数据回答:

滴加液体的体积(毫升) | 0 | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 20 |
pH | 13.1 | 12.8 | 12.3 | 11.5 | 10.4 | 7.0 | 2.7 | 2.3 | 2.2 | 2.1 | 2.0 |
温度(℃) | 25.5 | 25.8 | 26.1 | 26.4 | 26.8 | 27.0 | 26.9 | 26.8 | 26.7 | 26.6 | 26.6 |
③混合前,烧杯内的是_______________溶液,判断的依据是________。
④当滴加液体体积为________________mL时,酸碱中和反应恰好完成。根据表格数据可判断;中和反应是____________(填“吸热”“放热”或“无变化”)的反应,理由是__________
⑤当滴加液体6mL时,烧杯中的溶质(除酚酞以外)有________(填化学式);若酚酞无色则滴加液体的体积可能是___________mL
A 4 B 8 C 10 D 14
⑥有同学发现在实验过程中,开始时没有气泡,持续滴加液体后,观察到有气泡产生,请分析可能的原因________,并设计实验证明你的结论________________
⑦现有两杯质量相同、溶质质量分数相同的NaOH溶液和KOH溶液,在NaOH溶液中加入xg盐酸恰好中和;在KOH溶液中加入yg上述盐酸也能恰好中和,则x____________y
A > B < C = D 无法判断
【题目】某CO气体中混有少量的CO2,为探究CO的性质,某同学在老师的指导下设计了以下实验装置,请填写下列空白.
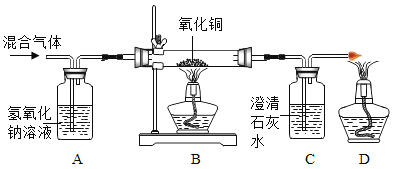
(1)A装置的作用是___________.B处玻璃管内的现象是___________.
(2)C处反应的化学方程式为___________;
(3)实验时,应___________(选填“先”或“后”)点燃B处的酒精灯;
(4)某同学对B处玻璃管内剩余固体成分产生浓厚兴趣.
(提出问题)B处玻璃管内的剩余固体是什么?
(假设猜想)猜想①:剩余固体全部是铜 猜想②:剩余固体是铜和氧化铜的混合物
(实验设计)
实验步骤 | 实验中可能出现的现象 | 结论 |
取B处玻璃管内少量剩余固体于试管中加入 ___________ | 现象一:固体不溶解,溶液不变色 | 猜想①___________(选填“成立”或“不成立”) |
现象二: ___________ | 猜想②成立 |
(拓展延伸)
(Ⅰ)D处酒精灯的作用是___________;
(Ⅱ)根据B处的反应原理,CO可用于___________.