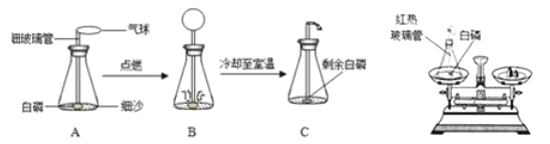
��Ŀ����
����Ŀ������Ϊ25��ʱ,ijС������ˮ�Ȼ�ͭ��ĩ�Ʊ��Ȼ�ͭ����,�Ʊ��������£�
����I:��������,�õ��Ȼ�ͭ�ܽ����������
�¶�(��) | 0 | 20 | 25 | 40 | 50 | 60 | 80 |
�ܽ��(g) | 69.2 | 74.5 | 76.4 | 81.8 | 85.5 | 89.4 | 98.0 |
�����:��������CuCl2�ȱ�����Һ,��ȴ�ᾧ,�õ����֡�
�����:�Ѿ��������������Ƶ�CuCl2�ȱ�����Һ��,�����¾�������,�γɴ��塣
�����:ȡ������,����ʣ�����Һ(ĸҺ)��
����������Ϣ,�ش��������⣺
(1)��20mL����ˮ(�ܶ�ԼΪ1g/mL)����50����Ȼ�ͭ������Һ��
�ټ������ȡCuCl2��������_______g��
�ڽ���ȡ��CuCl2�����20mLˮ�����ձ��У�_______________����������ƣ���ֱ��������ȫ�ܽ⡣
(2)ĸҺ��Cu2+�����ؽ������ӣ������ŷŽ����»�����Ⱦ�����з���������ĸҺ��������__________��
A���ռ�ĸҺ�ڳ��������У��ñ�ֽ��ס�����ڣ���ˮ����Ȼ���ɺ����ù���
B����ĸҺ�м�������AgNO3����ַ�Ӧ����ˣ��������ﱣ�棬��Һ������ˮ��
C����ĸҺ�м�������NaOH����ַ�Ӧ����ˣ��������ﱣ�棬��Һ������ˮ��
(3)���������û���ĸҺ�е�ͭ��100gĸҺ��Ҫ���۵�����������_____________ g(ֻ�м���ʽ����֪CuCl2����Է�������Ϊ135)��
���𰸡� 17.1 ���� A C ![]()
��������(1) ���ܽ����һ���¶��£�100g�ܼ���ﵽ����ʱ�����ܽ�����ʵ��������ɱ��������ݿ�֪��50��ʱ���Ȼ�ͭ���ܽ��Ϊ85.5g����20mL����ˮ(�ܶ�ԼΪ1g/mL)����50����Ȼ�ͭ������Һ�� ���ȡCuCl2��������17.1g���ڽ���ȡ��CuCl2�����20mLˮ�����ձ��У��ò��������裬ֱ��������ȫ�ܽ���(2) A����������Ϣ��֪���Ȼ�ͭ���ܽ�����¶�Ӱ�첻�������������ᾧ���ᴿ���ռ�ĸҺ�ڳ��������У��ñ�ֽ��ס�����ڣ���ֹ��������������������������ˮ����Ȼ���ɣ������ᾧ�������ù��������к�ͭ���ӵ�Һ���ŷţ����ᵼ����Ⱦ����ȷ��B����ĸҺ�м�������AgNO3����ַ�Ӧ�����ɵij������Ȼ��������ˣ��������ﱣ�棬��Һ����Ȼ��ͭ������������ˮ�����Իᵼ����Ⱦ��C����ĸҺ�м�������NaOH������������ͭ�������Ȼ�������ַ�Ӧ����ˣ��������ﱣ�棬��Һ��ֻ���Ȼ�����û��ͭ������������ˮ�����������ؽ���������Ⱦ��(3)��������Ϣ��֪��25��ʱ�Ȼ�ͭ���ܽ��Ϊ76.4g��100gĸҺ�к����Ȼ�ͭ������Ϊx��76.4g/176.4g=x/100g x=100g��76.4g��176.4g�����������û���ĸҺ�е�ͭ����100gĸҺ��Ҫ���۵�����������y��
CuCl2 + Fe = FeCl2 + Cu
135 56
![]() y 135/
y 135/![]() =56/y
=56/y
![]()

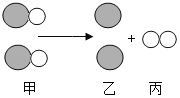
����Ŀ��������(Mn)���仯������;�㷺�����̺Ͻ�(�̸�)�����������������ݵ�������ݶ����ϡ����졢�����ȡ������̵Ļ��������ɫ���ܽ��Լ��±����ش��������⡣
���� | KMnO4 | MnO2 | MnSO4 | Mn(OH)2 | MnO(OH)2 |
��ɫ | ����ɫ | ��ɫ | ��ɫ | ��ɫ | ��ɫ |
�ܽ��� | ���� | ���� | ���� | ���� | ���� |
(1)KMnO4����______________���㷺����ҽҩɱ�����ͷ�������
(2)���ʵ�����������ʯ(Fe2O3)�����̿�(MnO2)����̿��ϼ����¯,ͨ���ȿ�������,�ɵõ����̺Ͻ��û�ѧ����ʽ��ʾ���ɽ����̵Ĺ��̣�
��C + O2![]() CO2���� _______________________���� ________________________��
CO2���� _______________________���� ________________________��
(3)��֪:��MnSO4+2NaOH=Mn(OH)2��+Na2SO4; ��2Mn(OH)2+O2=2MnO(OH)2 ����ʢ��MnSO4��Һ���Թ��м�������NaOH��Һ,����,Ԥ��ɹ۲쵽��������______________��
����Ŀ���������б����е���Ϣ�ش����⡣
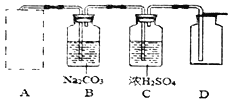
A������������Һ�Ͷ������̻�� | B�����ȸ������ | C����ȼ�� |
|
|
|
(1)A��Bʵ�������ݱ仯��ϵ���Ӧͼ���������____(����ĸ���)��
(2)A�з�Ӧ�����ֱ���ʽ��____��
(3)C�пɹ۲쵽����������ȼ�գ�����____���棬����______��ζ����ɫ���壬�˷�Ӧ�����ֱ���ʽ___________��