题目内容
【题目】根据下表中的数据,回答下列问题:
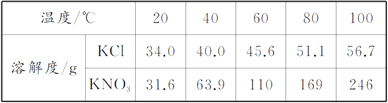
(1)20℃时KCl的溶解度是________;
(2)20℃时将20 g KCl与50 g水混合,充分溶解后,所得溶液为____________ (填“饱和”或“不饱和”)溶液;
(3)上表两种物质中,__________的溶解度受温度的影响大。
【答案】 34.0g 饱和溶液 KNO3
【解析】(1)从溶解性表中的数据可知20℃时,KCl的溶解度是34.0g;(2)20℃时,KCl的溶解度是34.0g,表示100g水中溶解34g氯化钾达到饱和,所以将20gKCl固体加入50g水中只能溶解17g氯化钾,形成溶液为饱和溶液;(3)由表格可以看出随着温度的升高,硝酸钾的溶解度变化较大,故填:KNO3。

 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案【题目】二氧化碳与我们生活息息相关,兴趣小组利用图9装置进行多角度探究。
【资料查阅】(1)浓盐酸具有挥发性,能挥发出氯化氢气体
(2)HCl与AgNO3溶液发生反应,生成白色沉淀(白色沉淀为不溶于水也不溶于酸的AgCl)。
(3)盐酸可与石灰水反应:Ca(OH)2+2HCl═CaCl2+2H2O

探究一 气体的制取
(1)写出图中①的仪器名称:_____。
(2)用装置A制取二氧化碳的反应化学方程式是_____。若装置A用于实验室制取氧气,则反应化学方程式是_____。
(3)生活中有许多物品可以代替实验仪器。关闭K2和K3,打开K1,若用装置F所示的医用塑料袋排空气法收集CO2,则F装置_____(填“a”或“b”)端与B装置相连。
探究二 气体的性质检验
打开K2、关闭K1和K3,用于检验制取的二氧化碳性质。
(4)若装置C中是紫色石蕊试剂,可观察到_____(填现象),证明二氧化碳与水发生了反应。若装置C中试剂是澄清石灰水,则该反应的化学方程式是_____。
(5)小强将制取的二氧化碳通入澄清石灰水中,未见浑浊,小强认为是使用的盐酸浓度过高,挥发进入石灰水中。要验证是否是上述原因,设计实验方案为:_____。
探究三 测定气体生成的反应速率
关闭K1、K2,打开K3,可测一段时间内生成二氧化碳气体的速率。所测得数据如下:
稀盐酸的体积(mL) (反应前) | 大理石质量(g)(反应前) | E装置收集的液体量(mL) | 反应时间(s) |
50 | 5.0 | 37.8 | 100 |
(6)由实验数据可知,生成CO2的体积为_____ mL。
(7)若生成气体的反应速率用公式v =△V/△t表示(△V表示生成气体的体积、△t表示反应所用的时间),则生成的二氧化碳的速率为_____ mL/s。
(8)有同学认为,图中的测量方法容易带来误差,请指出造成误差的原因_____(写一点)。