题目内容
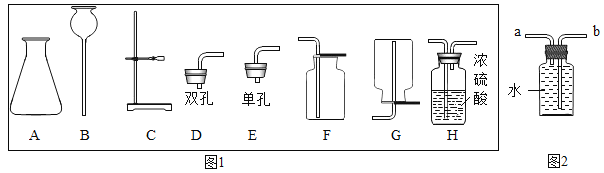
【题目】下列装置常用于实验室制取气体。请根据给出的装置回答下列问题。
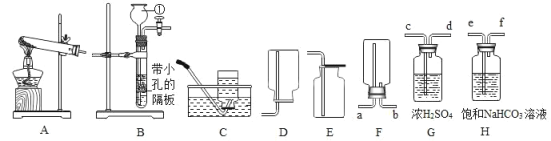
(1)写出仪器①的名称_____。
(2)实验室用氯酸钾制取氧气,应选用的发生装置是_____(填字母标号),化学方程式是_________,若用 C 装置收集氧气,当观察到_____时,开始收集。
(3)用 B 和E 装置制取并收集CO2,反应的化学方程式为_____。选择装置B作为制取CO2气体的发生装置,其突出优点是_____________________, 若改用 F 装置收集二氧化碳,则气体应从_____(填“a”或“b”)端进入。制得的二氧化碳中常含有少量的氯化氢气体和水蒸气,欲使用 G、H 装置将以上杂质气体除去,则装置正确的连接顺序是:混合气体→_____→_____→_____→_____(用导气管端口字母表示)。
(4)已知:一氧化氮(NO)是生命体系信息分子之一,在常温下,它是难溶于水且不与水反应,易与O2 反应生成二氧化氮(NO2)的气体。实验室收集少量NO 的装置可用_____ (填字母标号)。
【答案】长颈漏斗 A 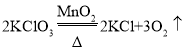 气泡连续且均匀冒出 CaCO3+2HCl=CaCl2+H2O+CO2↑ 可控反应的发生和停止 b e f c d C
气泡连续且均匀冒出 CaCO3+2HCl=CaCl2+H2O+CO2↑ 可控反应的发生和停止 b e f c d C
【解析】
(1)仪器①的名称是长颈漏斗。故填:长颈漏斗。
(2)实验室用氯酸钾制取氧气,氯酸钾和二氧化锰都是固体,反应条件需要加热,所以应选用的发生装置是A;反应的化学方程式是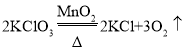 ;若用 C 装置收集氧气,刚排除的气体是试管中的空气,为保证收集的气体纯净,必须当观察到气泡连续且均匀冒出时,开始收集。故填:A;
;若用 C 装置收集氧气,刚排除的气体是试管中的空气,为保证收集的气体纯净,必须当观察到气泡连续且均匀冒出时,开始收集。故填:A;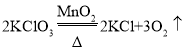 ;气泡连续且均匀冒出。
;气泡连续且均匀冒出。
(3)用 B和E 装置制取并收集CO2,制取二氧化碳的药品是碳酸钙和稀盐酸,反应生成氯化钙、水和二氧化碳,反应的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑;选择装置B作为制取CO2气体的发生装置,大理石固体放在多孔隔板上,稀盐酸从长颈漏斗加入,当盐酸加入到液面与隔板上大理石接触,反应发生,关闭止水夹,气体无法排出去,装置中压强增大,会压着稀盐酸回到长颈漏斗中,盐酸液体与大理石脱离接触反应停止,所以其突出优点是可控反应的发生和停止; 若改用 F 装置收集二氧化碳,二氧化碳的密度比空气大,瓶中的空气被从长的导管(即a端)口导出,所以二氧化碳气体应从 b端进入;制得的二氧化碳中常含有少量的氯化氢气体和水蒸气,欲使用 G含有浓硫酸(具有吸水性)用来吸收水分,H 装置含有饱和碳酸氢钠溶液,用来吸收氯化氢气体(易溶于水),不减少二氧化碳的量,经过饱和碳酸氢钠溶液的气体又会带出水蒸气来,所以要先让气体经过饱和碳酸氢钠除去氯化氢,再通过浓硫酸吸收水分,所以装置正确的连接顺序是:混合气体→e→f→c→d。故填:CaCO3+2HCl=CaCl2+H2O+CO2↑;可控反应的发生和停止;b;e;f;c;d。
(4)一氧化氮(NO)在常温下,难溶于水且不与水反应,易与O2 反应生成二氧化氮(NO2)的气体,所以不能用排空气法收集气体,只能用排水法收集,所以实验室收集少量NO的装置可用C。故填:C。

 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案