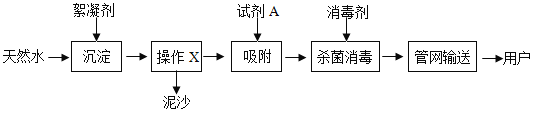
题目内容
【题目】以FeSO4为原料制备铁黑颜料Fe3O4(其中Fe既有+2价,也有+3价)的过程如下:
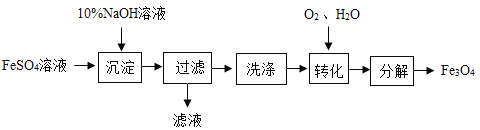
“转化”过程的反应为:4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3。若原料中含FeSO4 9.12 t,下列说法正确的是
A.理论上与FeSO4反应的NaOH溶液的质量为4.8 t
B.理论上“转化”过程参与反应的O2的质量为480 kg
C.该方法理论上最终可以获得Fe3O4的质量为4.64 t
D.若“转化”过程参与反应的O2过量,则最终所得固体的质量偏小
【答案】C
【解析】
在FeSO4溶液中加入NaOH溶液,先生成白色絮状沉淀,反应化学方程式为:FeSO4+2NaOH=Fe(OH)2↓+Na2SO4,氢氧化亚铁不稳定,很快被氧化成灰绿色,最终被氧化成红褐色的氢氧化铁沉淀,反应的化学方程式为:4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3。
A、设理论上与FeSO4反应的NaOH的质量为x,
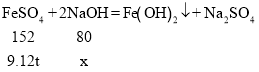
![]() x=4.8t
x=4.8t
氢氧化钠溶液的质量分数为10%,故反应的氢氧化钠溶液的质量为![]() ,故A错误;
,故A错误;
B、理论上“转化”过程参与反应的O2的质量为y,则
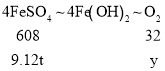
![]() ,y=0.48t=480kg
,y=0.48t=480kg
为了得到Fe3O4(可以看成是FeO和Fe2O3的等分子混合的混合物),所以FeSO4中转化为氢氧化亚铁和氢氧化铁的FeSO4的质量比为1:2,也就是FeSO4中的铁只能有三分之二转化为Fe(OH)3,所以O2的理论用量为480kg的三分之二,即320kg,故B错误;
C、根据铁元素守恒,设该方法理论上最终可以获得Fe3O4的质量为:![]() ,故C正确;
,故C正确;
D、该方法理论上最终可以获得Fe3O4的质量为![]() ,若“转化”过程参与反应的O2过量,则最终所得固体为Fe2O3,质量为
,若“转化”过程参与反应的O2过量,则最终所得固体为Fe2O3,质量为![]() ,质量偏大,故D错误。
,质量偏大,故D错误。
故选C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
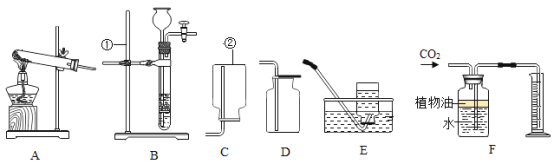
小学生10分钟应用题系列答案【题目】实验装置及实验操作是化学实验的基本内容
(1)请将体现下列实验操作目的正确选项,填在对应的横线上。
A防止药品污染 B防止试管破裂 C减少实验误差
加热试管时,先均匀加热后集中加热____________,滴管使用后,及时清洗并放在试管架上____________,量取液体时,视线与凹液面最低处保持水平__________。
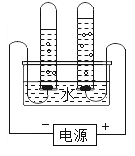
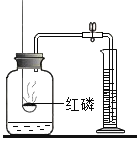
(2)下列实验装置中均有水,请根据实验解释水在其中的主要作用。
A | B | C | D | |
实验装置 | 铁氧气中燃烧
| 测定空气中氧气含量
| 水通电分解
| 探究燃烧的条件
|
解释 | 集气瓶中的水:冷却溅落融熔物,防止集气瓶炸裂 | _____________ | _____________ | _____________ |