题目内容
【题目】40g10%的氢氧化钠溶液和40g10%的稀盐酸充分混合,混合后的溶液与下列物质能反应的是( )
A.Na2CO3溶液B.NaCl溶液C.稀硫酸D.CO2气体
【答案】A
【解析】
40g10%的氢氧化钠溶液和40g10%的稀盐酸充分混合,盐酸与氢氧化钠溶液中所含溶质的质量相等。
反应中消耗盐酸酸与氢氧化钠的质量比关系如下: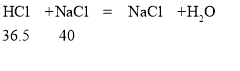
可知,36.5份质量的盐酸与40份质量的氢氧化钠恰好完全反应,则充分混合后,稀盐酸有剩余,所得溶液是氯化钠和盐酸的混合溶液。
A、稀盐酸能与碳酸钠溶液反应生成氯化钠、水和二氧化碳,故选项正确。
B、稀盐酸不能与氯化钠溶液反应,故选项错误。
C、稀盐酸、氯化钠均不能与稀硫酸应,故选项错误。
D、稀盐酸、氯化钠均不能与二氧化碳气体反应,故选项错误。
故选:A。

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
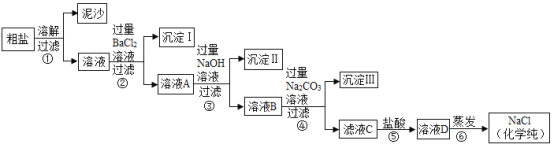
小博士期末闯关100分系列答案【题目】有一包白色粉末可能含有氯化钡、碳酸钡、碳酸钠、氢氧化钠和硫酸钠中的一种或几种,取一定量该粉末样品加入到盛有足量水的烧杯中,搅拌,静置,观察到烧杯中有白 色不溶物。同学们将烧杯中的物质过滤,得到滤渣A和滤液B,取滤渣A于试管中滴加过 量稀盐酸,观察到滤渣全部溶解,并有气泡产生。为确定白色粉末的组成,同学们进一步设计了如下实验方案:

(查阅资料)硝酸钠、硝酸钡、氯化钡溶液均显中性。
针对上述实验方案中各步骤的现象,小明同学提出下列三种不同的假设,依据每种假 设中各步骤不同的实验现象,可得出不同的实验结论。
步骤一 | 步骤二 | 步骤三 | |
假设一 | 有白色沉淀生成 |
|
|
假设二 | 无白色沉淀生成 | 溶液变红 | 溶液变成无色 |
假设三 | 无白色沉淀生成 | 无明显现象 | 无明显现象 |
(1)依据假设一的现象,可确定原白色粉末中只含有碳酸钡、碳酸钠、氢氧化钠和硫酸钠四种物质,则步骤二的现象是____;步骤三的现象是____;步骤一中发生反应的化学方程式是____(写出一个即可)。
(2)依据假设二的现象,原白色粉末可能的组成是___(任写一种可能的组 成,用化学式表示),步骤三中发生反应的化学方程式是____。
(3)依据假设三的现象,原白色粉末可能的组成有_____种。