题目内容
现有一杯8%的氢氧化钠溶液50g,丹丹同学向烧杯中倒入50g稀硫酸后,用玻璃棒搅拌并测得完全反应后的溶液呈中性.2NaOH+H2SO4═Na2SO4+2H2O.(1)反应后溶液的pH
(2)若将氢氧化钠溶液中溶质的质量分数变为原来的
| 1 | 2 |
(3)求上述反应后的溶液中溶质的质量分数.
分析:(1)溶液的酸碱性与溶液酸碱度的关系:pH>7,溶液呈碱性;pH=7,溶液呈中性;pH<7,溶液呈酸性;
(2)溶液加水稀释时,稀释前后溶液中的溶质质量不变,根据溶质质量不变可由稀释前氢氧化钠溶液的质量计算稀释时所加水的质量;
(3)反应后的溶液中溶质的质量分数=
×100%,根据反应的化学方程式,由氢氧化钠的质量计算生成硫酸钠的质量;利用质量守恒定律求反应后所得溶液的质量.
(2)溶液加水稀释时,稀释前后溶液中的溶质质量不变,根据溶质质量不变可由稀释前氢氧化钠溶液的质量计算稀释时所加水的质量;
(3)反应后的溶液中溶质的质量分数=
| 硫酸钠的质量 |
| 反应后溶液的质量 |
解答:解:(1)根据测得完全反应后的溶液呈中性,可判断,反应后溶液pH=7;
故答案为:=;
(2)设应加入水的质量为x
50g×8%=(50g+x)×4% x=50g
故答案为:50;
(3)设反应后生成的硫酸钠质量为x
2NaOH+H2SO4=Na2SO4+2H2O
80 142
50g×8% x
=
x=7.1g
则反应后溶液中溶质的质量分数=
×100%=7.1%
答:反应后的溶液中溶质的质量分数为7.1%.
故答案为:=;
(2)设应加入水的质量为x
50g×8%=(50g+x)×4% x=50g
故答案为:50;
(3)设反应后生成的硫酸钠质量为x
2NaOH+H2SO4=Na2SO4+2H2O
80 142
50g×8% x
| 80 |
| 50g×8% |
| 142 |
| x |
则反应后溶液中溶质的质量分数=
| 7.1g |
| 50g+50g |
答:反应后的溶液中溶质的质量分数为7.1%.
点评:氢氧化钠溶液与稀硫酸完全后溶液呈中性,可判断两溶液恰好完全反应,反应既无气体也无沉淀,根据质量守恒定律,反应后所得溶液的质量=氢氧化钠溶液质量+稀硫酸的质量.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 ,则应加入水为 ______g.
,则应加入水为 ______g.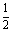 ,则应加入水为 g。
,则应加入水为 g。 ,则应加入水为 ______g.
,则应加入水为 ______g.