题目内容
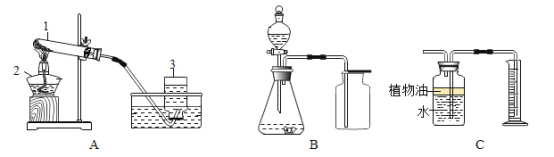
【题目】欲测定盐酸与氯化钙的混合溶液中氯化钙的质量分数,进行了如下实验:取混合溶液100g于锥形瓶中,向其中逐渐加入一定溶质质量分数的碳酸钠溶液(如图一),并不断测定锥形瓶中溶液的pH,反应过程中所得溶液的pH与锥形瓶中物质的总质量的关系如图二所示。其中,当锥形瓶中溶液的质量增加至147.8g时,共消耗碳酸钠溶液的质量为50g. (忽略二氧化碳在水中溶解的量;氯化钙溶液显中性。)
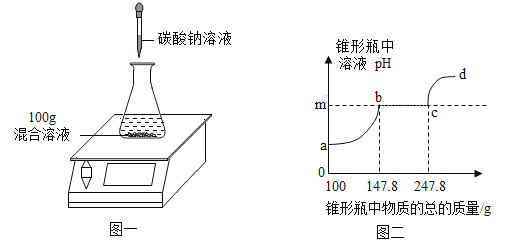
(1)m点的数值是_____。
(2)参加反应的碳酸钠溶液的溶质的质量分数是_____。
(3)请计算图二中C点时溶液中溶质的质量分数_____(写出计算过程,最后结果精确到0. 1%)。
【答案】7 10.6% 7.4%
【解析】
(1)根据图可以看出碳酸钠先和盐酸反应然后和氯化钙反应,所以m对应的溶液中溶质为氯化钠、氯化钙,溶液的pH为7;
(2)a→b段质量变化,是因为生成的二氧化碳,所以生成的二氧化碳的质量为100g+50g-147.8g=2.2g;
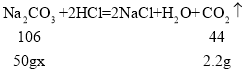
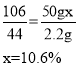
(3)设 碳酸钠与盐酸反应生成的 NaCl 质量为y,
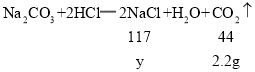
![]() y=5.85g
y=5.85g
由图二可知与氯化钙反应的碳酸钠溶液的质量为 ![]() ,其中碳酸钠的质量为10.6g,设 CaCl2与碳酸钠反应生成的质量生成 NaCl 的质量为 z,生成 CaCO3的质量为 m,则:
,其中碳酸钠的质量为10.6g,设 CaCl2与碳酸钠反应生成的质量生成 NaCl 的质量为 z,生成 CaCO3的质量为 m,则:
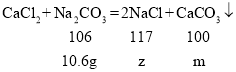
![]()
z=11.7g m=10g
C 点时溶液中溶质的质量分数为:![]()
答:C 点时溶液中溶质的质量分数为:7.4%

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目