��Ŀ����
����Ŀ��Ԫ�����ڱ���ѧϰ���о���ѧ����Ҫ����.������Ԫ�����ڱ��IJ�����Ϣ�������������Ϣ���ش��������⣺

��1���˵����Ϊ16��Ԫ������_____���ؿ��к������Ľ���Ԫ�ص�ԭ��������_____��
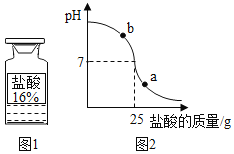
��2��Ԫ�����ڱ���ÿ���нС������ڣ�ÿһ���нС����塣ijԪ�ص�ԭ�ӽṹʾ��ͼ��ͼ1��ʾ�����Ԫ��Ӧ���ڵ�_____���ڣ�������ѧ��֪ʶ�Ʋ��Ԫ������_____��������ǽ�����Ԫ�ء�
��3����ԭ������Ϊ1��7��8������Ԫ����ɵ�����_____��д��ѧʽ����
��4��Ԫ�صĻ�ѧ�������Ƶ�ԭ�������ǵ�������������ͬ��������Ϣ�ж����и���Ԫ�صĻ�ѧ�������Ƶ���_____������ĸ��ţ���
A 
B 
C Al��Si
D F��C1
���𰸡��� 13 5 �ǽ��� NH4NO3 BD
��������
��1���˵����Ϊ16��Ԫ������Ϊ�ؿ��к������Ľ���Ԫ��������ԭ��������13��
��2��ԭ�ӵĵ��Ӳ�������Ԫ�������ڱ��е���������ijԪ�ص�ԭ�ӽṹʾ��ͼ��ͼ1��ʾ����������Ӳ㣩�����Ԫ��Ӧ���ڵ������ڣ���Ԫ��ԭ�ӵ�����������Ϊ7������4�����ڷǽ���Ԫ�أ�
��3����ԭ������Ϊ1��7��8������Ԫ�أ��⡢����������ɵ���������泥���ѧʽ��NH4NO3��
��4��Ԫ�صĻ�ѧ�������Ƶ�ԭ�������ǵ�������������ͬ����
A ��  ǰһ��Ԫ�����ȶ��ṹ������ʧ���ӣ���һ��Ԫ����ʧ���ӣ���ѧ���ʲ����ƣ�
ǰһ��Ԫ�����ȶ��ṹ������ʧ���ӣ���һ��Ԫ����ʧ���ӣ���ѧ���ʲ����ƣ�
B�� ![]() ��������������6�IJ��ȶ��ṹ����ѧ�������ƣ�
��������������6�IJ��ȶ��ṹ����ѧ�������ƣ�
C�� Al�ǽ���Ԫ�أ���ʧ���ӣ�Si�Ƿǽ���Ԫ�أ��õ��ӣ���ѧ���ʲ����ƣ�
D�� F��C1����������������7����Ӧ�У�һ��ԭ�Ӷ���1�����ӣ���ѧ�������ơ�
��ѡBD��

����Ŀ��ͬѧ��̽�����������������ܷ�����ѧ��Ӧ��
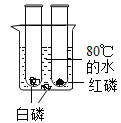
[̽���1]ͬѧ��������ͼʵ��:
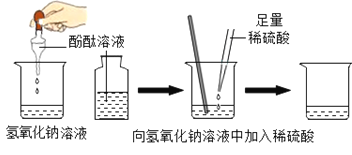
����һ����ϡ�����۲쵽��Һ�ɺ�ɫ��Ϊ��ɫ,֤�����߷����˷�Ӧ������ʵ���������һ�����Դ�������Ը���_______________��Ҫ֤��ϡ�������������Ʒ����˷�Ӧ��������������֮�⣬���������±�ʵ���ý��ۡ�
ʵ�鲽�� | ʵ������ | ʵ����� |
ȡ��������������Һ���Թ��У��������ϡ������ټ�����������ͭ | ________________ | �������ƺ����ᷢ���˷�Ӧ����������ͭ������Ӧ�Ļ�ѧ����ʽΪ_____________ |
[̽���2]�����[̽���1 ]��ֱ���㵹ϡ��������Һ�ɺ�ɫ��Ϊ��ɫ�������ձ��ڵ���Һ�����ʵijɷ���ʲô? ( ָʾ������)
[���������]�ײ���:�Ȼ���
�Ҳ���:_______________
��Ϊ��֤���Լ��IJ��룬��������ʵ��:
ʵ����� | ʵ������ | ʵ����� |
ȡ��Ӧ�����Һ���ձ��У��������� | _____________ | ������� |
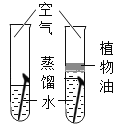
[̽���3 ]�кͷ�Ӧ�ܷ�ͨ���ж���ˮ������֤���䷴Ӧ����?
[���ʵ��]��ȡ��ɫ�轺����ˮ������������ƹ��������ͼ2�������Ա�ʵ�顣
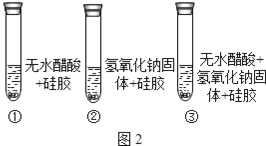
[��������] a.��ɫ�轺��ˮ������ɫ��Ϊ��ɫ;
b.��ˮ������һ���ᣬ������Ϊ��ɫҺ��;
(1)�����Լ���.ҪѸ������������ԭ����___________��
(2)��֤����ͼӦ��ˮ���ɵ�������___________��